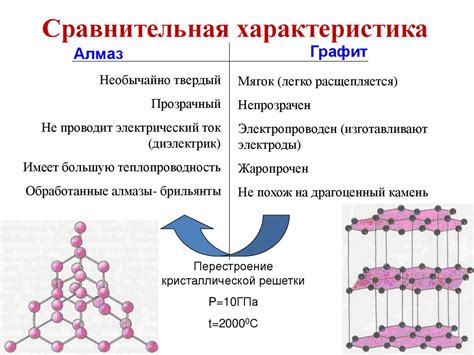
Алмаз и графит - две разновидности одного и того же химического элемента - углерода. Они обладают полностью различными физическими и химическими свойствами и являются одними из наиболее известных и распространенных аллотропных форм углерода.
Алмаз обладает рядом уникальных свойств, которые делают его одним из самых ценных и востребованных драгоценных камней. Он является самым твердым известным материалом на планете, имея максимальное значение на шкале твердости Мооса. Эта уникальная физическая особенность делает алмаз непригодным для обработки обычными инструментами.
В отличие от алмаза, графит является одним из самых мягких материалов. На макроскопическом уровне графит представляет собой слоистую структуру, сформированную из гексагональных плоских слоев атомов углерода.
Необычайные свойства алмаза и графита обусловлены их различной кристаллической структурой. В алмазе каждый атом углерода связан с четырьмя соседними атомами, образуя трехмерную решетку, тогда как в графите атомы углерода связаны только с тройными связями и образуют плоские слои.
Физические свойства алмаза и графита
Алмаз – твёрдое кристаллическое вещество, обладающее высокой твердостью и прозрачностью. У данного материала три измерения кристаллической решетки имеют форму правильного октаэдра, что делает его одним из самых твердых материалов, существующих на Земле. Алмаз имеет также очень высокий коэффициент преломления света, поэтому его часто используют в ювелирной и оптической промышленности.
Графит, в отличие от алмаза, является мягким и смазочным материалом. У него слоистая структура, при которой плоские слои атомов углерода тонко наслоены друг на друга и образуют упорядоченную решетку. Благодаря этой структуре, графит обладает низкой твердостью, но высокой электропроводностью и теплоотдачей. Графит широко применяется в промышленности, особенно в производстве электродов, карандашей и смазок.
Таким образом, алмаз и графит являются уникальными материалами с различными физическими свойствами, которые определяют их разнообразные применения в различных отраслях промышленности и науке.
Твердость
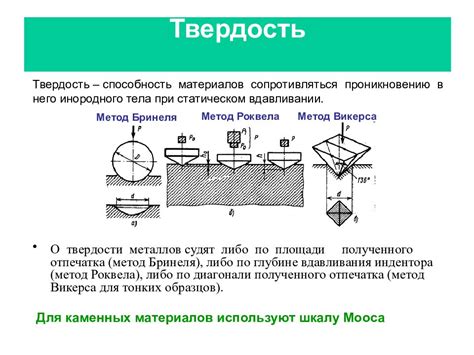
Твердость алмаза обусловлена его кристаллической структурой. У алмаза каждый атом связан с другими атомами алмаза ковалентными связями. Такая структура делает алмаз очень прочным и устойчивым к механическим нагрузкам. Именно благодаря своей твердости, алмаз используется в индустрии для производства инструментов для резки и шлифовки других материалов.
С другой стороны, графит обладает совершенно другой структурой, а именно плоскость атомов у графита связаны слабыми физическими силами. Это позволяет слоям графита скользить друг по другу, обеспечивая ему мягкость и смазывающие свойства.
Таким образом, различия в структуре алмаза и графита определяют их различную твердость. Алмаз - самый твердый известный материал, в то время как графит является мягким и смазочным. Эти свойства делают их полезными в различных областях, от производства инструментов до использования в карандашах.
Проводимость электричества

- Алмаз является непроводящим материалом. Он обладает очень низкой электрической проводимостью и практически не пропускает электрический ток. Это связано с особенностями его кристаллической структуры, в которой каждый атом углерода тесно связан с четырьмя соседними атомами при помощи ковалентных связей. Эта сильная связь между атомами углерода делает алмаз очень прочным, но и мешает перемещению свободных электронов для проведения электрического тока.
- Графит, напротив, является хорошим проводником электричества. Его электрическая проводимость гораздо выше, чем у алмаза. Это объясняется отличием в структуре графита, в которой атомы углерода связаны слабее и образуют слои, между которыми существуют слабые взаимодействия. Именно из-за этого слабого связывания атомы углерода в графите могут свободно перемещаться в слоях, что позволяет проводить электрический ток.
Таким образом, алмаз и графит представляют собой крайности в проводимости электричества среди форм углерода. Алмаз, благодаря своей непроводимости, находит применение в приборостроении, электронике и ювелирной индустрии, в то время как графит широко используется в производстве электродов, лубрикантах и других отраслях, требующих хорошей электрической проводимости.
Структура и кристаллическая решетка
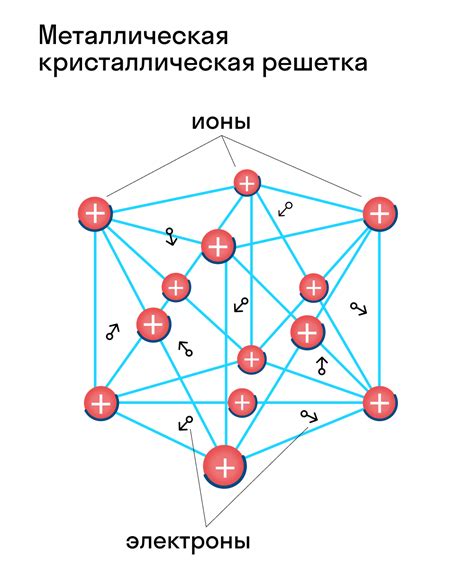
Алмаз и графит оба состоят из атомов углерода, но их структура и свойства сильно отличаются. Эти различия обусловлены особенностями их кристаллической решетки.
Алмаз имеет кубическую кристаллическую решетку, которая состоит из тетраэдров, образованных атомами углерода. Каждый атом углерода в алмазе связан с другими атомами углерода ковалентной связью, что придает алмазу его твердость и прочность. Кристаллическая решетка алмаза обладает сетчатой структурой, благодаря которой алмаз образует прозрачные и бриллиантовые кристаллы.
С другой стороны, графит обладает слоистой структурой. В графите каждый атом углерода связан с трех слоями соседних атомов углерода, а слои внутри графита связаны очень слабо взаимными силами ван-дер-ваальса. Это делает графит мягким и податливым, и придает ему свойство облегчать его слоями, позволяя проводить по бумаге или использовать в качестве смазки. Кристаллическая решетка графита образует графитовые слои, расположенные один над другим.
Таким образом, структура и кристаллическая решетка алмаза и графита обуславливают их разнообразные физические и химические свойства. Алмаз является одним из самых твердых и драгоценных камней, тогда как графит используется в различных областях, включая производство карандашей, смазки и даже в качестве компонента в некоторых материалах с высокой теплопроводностью.