Атомы, как известно, состоят из положительно заряженного ядра и отрицательно заряженных электронов, которые обращаются вокруг ядра на определенных энергетических уровнях. Однако, не все атомы имеют равное количество электронов и прочно удерживают их в своих оболочках. Именно поэтому некоторые атомы, взаимодействуя с другими атомами, могут отдать или принять электроны, чтобы достичь стабильного состояния и заполнить свои внешние энергетические уровни.
Процесс отдачи или принятия электронов имеет место в химических реакциях и определяет химические свойства веществ. Атомы стремятся достичь состояния максимальной стабильности, что обеспечивается полным заполнением внешних энергетических уровней электронами. Если атом имеет недостаток электронов, он будет стремиться принять дополнительные электроны от другого атома, чтобы достичь стабильности. В таком случае, атом становится отрицательно заряженным и превращается в ион.
С другой стороны, атомы с избытком электронов способны отдавать их, чтобы достичь стабильности. При этом, они становятся положительно заряженными ионами. Процесс, при котором атомы обмениваются (отдают или принимают) электроны, называется ионизацией или образованием ионных связей. Ионные связи позволяют атомам образовывать химические соединения и обеспечивают стабильность вещества.
Строение атома
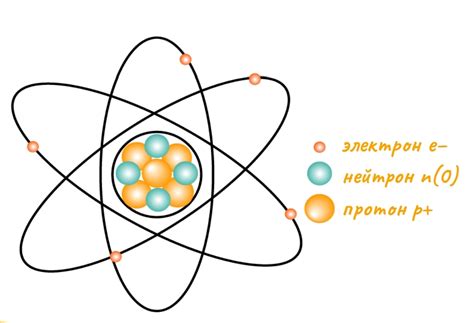
В облаке электронов находятся электроны, которые обращаются вокруг ядра по определенным энергетическим орбитам. Электроны имеют отрицательный электрический заряд, который равняется заряду протонов.
Структура атома представляет собой баланс между притяжением положительно заряженных протонов в ядре и отталкиванием отрицательно заряженных электронов. Если эта структура нарушается, атом становится нестабильным и может потерять или принять электроны, чтобы восстановить равновесие.
Атомы могут отдавать или принимать электроны для образования ионов. Ионы с положительным зарядом называются катионами и образуются, когда атом отдает один или несколько электронов. Ионы с отрицательным зарядом называются анионами и образуются, когда атом принимает один или несколько электронов.
Процесс отдачи или принятия электронов связан с достижением стабильной электронной конфигурации, которая обеспечивает атому наиболее благоприятное состояние. Этот процесс может происходить в реакциях с другими атомами или молекулами.
- Структура атома:
- Ядро атома, содержащее протоны и нейтроны;
- Облако электронов, содержащее электроны;
- Энергетические орбиты, по которым движутся электроны;
- Заряды протонов и электронов;
- Баланс притяжения и отталкивания;
- Образование ионов;
- Стабильная электронная конфигурация.
Валентность и октетное правило

Валентность атома определяется количеством электронов, которые он может отдать или принять в химической реакции. Это свойство взаимодействия атомов играет важную роль в формировании химических связей.
Октетное правило является основным правилом валентности и гласит, что атом стремится иметь в своей внешней электронной оболочке 8 электронов, чтобы быть стабильным и находиться в энергетически выгодном состоянии. Такое состояние подразумевает наличие полных энергетических уровней и отсутствие свободных мест для приема или передачи электронов.
Отдача и прием электронов происходят в результате образования химической связи между атомами. Атом с неполной внешней электронной оболочкой (имеющий меньше 8 электронов) может отдать свои электроны другому атому, чтобы оба атома достигли октетного состояния. Атом с неполной внешней оболочкой (имеющий больше 8 электронов) может принять электроны от другого атома, чтобы получить полную внешнюю оболочку.
Валентность атома определяет его способность отдавать или принимать электроны. Например, валентность водорода равна 1, поэтому он может отдать свой единственный электрон другому атому. Валентность кислорода равна 2, поэтому он может принять два электрона от другого атома. Валентность атома также может быть отрицательной, если он способен принимать электроны.
| Элемент | Валентность |
|---|---|
| Водород | 1 |
| Кислород | 2 |
| Хлор | 1 |
| Натрий | 1 |
| Калий | 1 |
Знание валентности атомов позволяет предсказывать и объяснять составление химических формул и реакций. Это является важной основой для понимания химической связи и химических процессов в общей химии и других областях науки.
Влияние электронной конфигурации
Атомы стремятся достичь наименее энергетически затратного состояния, то есть состояния с наиболее устойчивой электронной конфигурацией. Когда атом находится в неправильной электронной конфигурации, у него есть две основные стратегии, чтобы достичь стабильности: отдавать или принимать электроны.
Если атом имеет недостаток электронов во внешней оболочке, он может отдать свои электроны другому атому, который имеет потенциал и желание принять дополнительные электроны. Это происходит в случае с атомами, которые находятся слева от Бора в периодической системе элементов (например, металлы).
С другой стороны, атомы, которые имеют избыток электронов во внешней оболочке, могут принять дополнительные электроны от других атомов, чтобы достичь стабильности. Это происходит в случае с атомами, которые находятся справа от Бора в периодической системе элементов (например, неметаллы).
Таким образом, электронная конфигурация атома играет решающую роль в том, будет ли атом отдавать или принимать электроны при взаимодействии с другими атомами. Взаимодействие атомов и образование химических связей напрямую зависят от того, как электроны распределены в электронных оболочках атомов.
| Тип атома | Электронная конфигурация | Стратегия |
|---|---|---|
| Металлы | Отсутствие нескольких электронов во внешней оболочке | Отдают электроны |
| Неметаллы | Избыток электронов во внешней оболочке | Принимают электроны |
Диэлектрическая поляризация
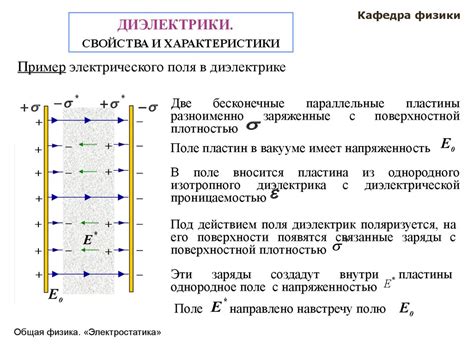
Когда внешнее электрическое поле приложено к диэлектрику, оно между атомами или молекулами создает электрические силы притяжения или отталкивания. В результате этих сил, электроны внутри атомов смещаются с их естественного положения, и атомы становятся электрическими диполями. Поэтому диэлектрик приобретает электрическую поляризацию.
Поляризация может быть постоянной или временной. Временная поляризация происходит в тех случаях, когда внешнее поле прекращается, а атомы или молекулы возвращаются в свое исходное положение. Постоянная поляризация наблюдается, когда внешнее поле остается постоянным и диэлектрик сохраняет свою поляризацию даже после отключения внешнего поля.
Диэлектрическая поляризация играет важную роль в электрических схемах и приборах. Например, она позволяет создавать конденсаторы - устройства, состоящие из двух проводящих пластин, разделенных диэлектриком. Поляризация диэлектрика в конденсаторе позволяет накапливать электрический заряд между пластинами и использовать его для различных целей, таких как хранение энергии, фильтрация сигналов или усиление сигналов.
Химические реакции и образование ионов
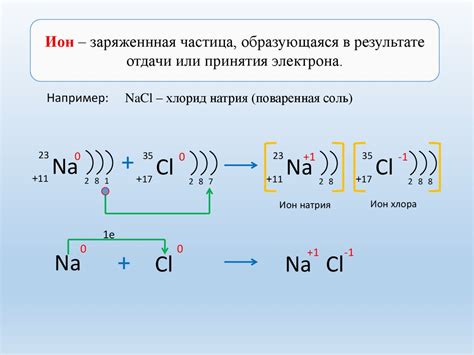
Образование ионов связано с изменением электронной структуры атомов вещества. Атомы стремятся достичь электронной конфигурации инертных (неактивных) газов, таких как гелий, неон и аргон. Для этого атомы отдают или принимают электроны, чтобы заполнить свои энергетические уровни.
В химических реакциях атомы могут либо отдавать электроны и превращаться в положительно заряженные ионы (катионы), либо принимать электроны и становиться отрицательно заряженными ионами (анионы). Катионы и анионы образуются в ионных соединениях, которые состоят из положительных и отрицательных ионов, притягивающихся друг к другу по принципу противоположных зарядов.
Образование ионов может происходить в различных условиях, например, при взаимодействии веществ с водой или при нагреве. Вода является хорошим растворителем многих веществ, и она способна разъединять их на ионы. Некоторые вещества, такие как кислоты и щелочи, могут ионизироваться сами по себе, образуя ионы в растворе.
Химические реакции и образование ионов являются основными процессами в химии. Эти процессы определяют поведение и свойства различных веществ и играют важную роль во многих аспектах нашей жизни, включая промышленность, медицину и пищевую промышленность.