В химии существует множество интересных реакций и взаимодействий, но не все соединения способны взаимодействовать между собой. Одной из таких реакций является отсутствие взаимодействия между этанолом и аммиачным раствором хлорида меди.
При рассмотрении химической структуры этанола и аммиачного раствора хлорида меди становится понятно, почему эти соединения не реагируют между собой. Этанол, или этиловый спирт, является органическим соединением, состоящим из углеродной цепи, на которую прикреплены два атома водорода и функциональная группа -OH.
Аммиак, в свою очередь, представляет собой соединение азота и водорода (NH3), которое образует аммиачный раствор, добавлением хлорида меди (CuCl). Хлорид меди вступает в реакцию с аммиачным раствором, образуя медиаммиачный комплекс. Однако, в данной системе не происходит взаимодействие с этанолом, поскольку его структура не предполагает образования комплексов с меди.
Взаимодействие этанола с аммиачным раствором хлорида меди: причины отсутствия реакции
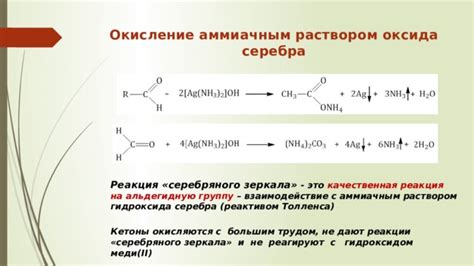
Реакции между различными веществами могут быть очень разнообразными и зависят от их химических свойств. Однако, в случае этанола и аммиачного раствора хлорида меди, отсутствие реакции можно объяснить несколькими факторами.
- Способность меди вступать в реакции с аммиачным раствором. Медь в аммиачном растворе образует комплексные соединения, такие как [Cu(NH3)4]2+. Эти соединения обладают достаточно высокой стабильностью и не вступают в реакцию с этанолом.
- Химические свойства этанола. Хотя этанол является растворителем многих органических и неорганических веществ, его реакционная способность с медью ограничена. Этанол не образует стабильные комплексные соединения с медью, что может быть одной из причин отсутствия реакции.
- Концентрация аммиачного раствора. Возможно, реакция между этанолом и аммиачным раствором хлорида меди протекала бы при более высокой концентрации аммиака или более высокой концентрации медионов в растворе. Однако, их низкая концентрация может быть причиной отсутствия реакции или ее низкой степени.
В целом, отсутствие реакции между этанолом и аммиачным раствором хлорида меди объясняется комбинацией различных факторов, таких как особенности химических свойств веществ и условий проведения эксперимента. Дальнейшее изучение состава и свойств этих веществ может привести к более подробному пониманию их реакционной способности и возможности вступления в взаимодействие друг с другом.
Натура реагентов и электрохимические свойства

Для понимания причин отсутствия реакции между этанолом и аммиачным раствором хлорида меди необходимо рассмотреть натуру данных веществ и их электрохимические свойства.
Этанол (C2H5OH) является алкоголем, содержащим гидроксильную группу. Он является аполярным соединением, что означает отсутствие зарядов, которые могли бы образовать ионы при растворении в воде. Вместо этого, этанол образует слабые ван-дер-ваальсовы взаимодействия с молекулами воды. Такие взаимодействия не способствуют хемической реакции с аммиаком или ионами меди.
Аммиак (NH3) является амфотерным соединением, способным взаимодействовать как с кислотами, так и с основаниями. В растворе аммиачной кислоты аммиак может образовывать ион аммония (NH4+), который является достаточно слабым окислителем, чтобы окислить этанол.
Хлорид меди (CuCl2) - соединение, содержащее ионы меди (Cu2+). Ионы меди обладают высокой окислительной способностью и способны вступать в окислительно-восстановительные реакции. Однако, в данном контексте, ионы меди не вступают в реакцию с этанолом из-за отсутствия подходящего окислителя или восстановителя.
Таким образом, отсутствие реакции между этанолом и аммиачным раствором хлорида меди обусловлено натурой реагентов и их электрохимическими свойствами.
Роль связей алкоголя и аммиака

Когда этанол и аммиак смешиваются, между ними возможна реакция, называемая протолизом. В этой реакции происходит образование новых связей между этанолом и аммиаком.
Однако, в случае аммиачного раствора хлорида меди (CuCl2(NH3)4), этанол не реагирует с аммиаком. Это объясняется тем, что аммиак уже связан с медионом и образует комплексный ион Cu(NH3)4^2+. Связи между аммиаком и ионом меди достаточно крепкие, и они не могут быть разорваны этанолом.
Таким образом, отсутствие реакции между этанолом и аммиачным раствором хлорида меди объясняется наличием комплексного иона, который уже установил сильные связи с аммиаком, и этанол не может конкурировать с ними.
Окислительно-восстановительные свойства раствора

Раствор аммиачного хлорида меди (CuCl2) обладает сильными окислительно-восстановительными свойствами, что значительно отличает его от этанола (C2H5OH). Окислительные свойства раствора CuCl2 обусловлены наличием двух медионов (Cu2+), которые обладают способностью принимать электроны и восстанавливаться до нейтрального состояния медного металла.
В то же время, этанол не проявляет окислительных свойств в реакции с аммиачным раствором хлорида меди. Это связано с тем, что этанол является сильным восстановителем и представляет собой единственный продукт реакции с Cu2+. Молекулы этанола способны передавать свои электроны медиону до полного восстановления меди и образования медного металла.
Таким образом, взаимодействие этанола с аммиачным раствором хлорида меди не приводит к реакции окисления Cu2+ до Cu и остаётся беззметилированным в результате реакции.
Структура и особенности молекулы хлорида меди
Особенностью молекулы хлорида меди является наличие внутренней кристаллической структуры. Между молекулами образуются кристаллические решетки, что придает соединению определенные физические свойства, такие как твердотельная структура и определенная температура плавления.
Интенсивный ионный характер связей между атомами меди и хлора объясняет низкую реакционную способность хлорида меди в присутствии других веществ, в том числе этанола. Например, этанол не реагирует с аммиачным раствором хлорида меди из-за слабой полярности этаноловой молекулы и низкой реакционной активности хлорида меди.
Таким образом, структура молекулы хлорида меди и ее особенности играют роль в химической активности соединения и в его взаимодействиях с другими веществами.
Энергетические и кинетические факторы реакции

Реакция между этанолом и аммиачным раствором хлорида меди не происходит вследствие различных энергетических и кинетических факторов.
Во-первых, реакция требует высокой энергии активации. В случае этанола и аммиачного раствора хлорида меди энергия активации слишком велика для их взаимодействия. Этанол имеет невысокую реакционную способность и обладает инертностью к многим химическим реакциям.
Во-вторых, для реакции требуется наличие катализатора. Аммиачный раствор хлорида меди сам по себе не является достаточно активным катализатором для реакции с этанолом. Катализатор может повысить скорость реакции и снизить энергию активации, но в данном случае это не происходит.
В-третьих, структура и электронные свойства этанола и аммиачного раствора хлорида меди не совпадают, что также препятствует их реакции. Этанол является полярной молекулой, а медь в хлориде меди находится в оксидационном состоянии II. При обычных условиях взаимодействие данных веществ будет неэффективным.
Таким образом, отсутствие реакции между этанолом и аммиачным раствором хлорида меди связано с высокой энергией активации, отсутствием активного катализатора и несовпадением структуры и электронных свойств данных веществ.
Условия и причины возникновения альтернативных реакций

Несмотря на то, что аммиачный раствор хлорида меди обычно реагирует с этанолом, существуют условия и причины, которые могут вызывать альтернативные реакции или препятствовать их возникновению.
Одной из возможных причин является неправильная концентрация реагентов. Если концентрация этанола недостаточно высока, может происходить неполная реакция или вообще отсутствовать реакция с аммиачным раствором хлорида меди.
Другой возможной причиной может быть использование неподходящего катализатора. Катализаторы могут влиять на скорость и характер реакции. Если используется неподходящий катализатор или его концентрация недостаточна, альтернативные реакции могут возникнуть или не возникнуть вовсе.
Также фактором, влияющим на возникновение альтернативных реакций, могут быть условия проведения реакции. Например, недостаточное время взаимодействия реагентов или неправильная температура могут препятствовать реакции между этанолом и аммиачным раствором хлорида меди.
Дополнительно, химические свойства реагирующих веществ также могут влиять на возникновение альтернативных реакций. У этанола и аммиачного раствора хлорида меди есть свои химические особенности, которые могут привести к альтернативным реакциям, например, образованию различных продуктов или недостаточному взаимодействию между реагентами.
Таким образом, для успешной реакции между этанолом и аммиачным раствором хлорида меди необходимо учитывать различные факторы, включая концентрацию реагентов, катализаторы, условия проведения реакции и химические свойства реагирующих веществ.



