Лед и вода - два фундаментальных состояния, в которых может находиться водяной пар, обладают удивительными физическими свойствами, которые определяют их поведение и функции в природе и нашей повседневной жизни. Лед, при определенных условиях, может быть кристаллической твердой субстанцией, в то время как вода – жидкостью. Такое различие происходит из-за особенностей структуры и сил взаимодействия между молекулами воды, а также влияния факторов окружающей среды.
Молекулы воды состоят из двух атомов водорода и одного атома кислорода, связанных с помощью ковалентных связей. Вода является полярной молекулой, что означает, что ее заряд распределен неравномерно: одна сторона молекулы имеет частичный положительный заряд, а другая – отрицательный. Именно эта полярность позволяет молекулам воды взаимодействовать между собой с помощью водородных связей, образуя сеть водородных связей.
Когда вода находится в жидком состоянии, молекулы взаимно смещаются и совершают быстрые колебания, не сохраняя постоянный порядок. Это объясняет ее способность литься и принимать форму сосудов, в которых она находится. Когда температура понижается до определенного уровня, вода начинает образовывать кристаллическую решетку, и ее молекулы принимают определенное положение. Вода превращается в лед.
Структура молекул и их взаимодействие
Различие в физических свойствах между льдом и водой обусловлено их уникальной структурой молекул. Вода, химическая формула которой H2O, состоит из одного атома кислорода и двух атомов водорода. Эти атомы связаны между собой ковалентной связью.
Когда вода находится в жидкой фазе, ее молекулы находятся в постоянном движении и обладают высокой подвижностью. Они отталкиваются друг от друга, образуя нерегулярную сеть взаимодействий, которая обуславливается слабыми силами взаимодействия между молекулами. Такие силы называются ван-дер-ваальсовыми силами.
Когда температура воды снижается до нуля градусов Цельсия, молекулы воды начинают замедлять свое движение и подвергаться воздействию сильных взаимодействий. При этом молекулы воды начинают организовываться в регулярную структуру, известную как кристаллическая решетка льда. Кристаллическая решетка льда представляет собой трехмерную сеть, в которой каждая молекула воды связана с другими молекулами через водородные связи.
Водородные связи являются сильными электростатическими взаимодействиями между атомами водорода и атомами кислорода. Эти связи обладают большими энергетическими барьерами и сохраняются даже при низких температурах. Благодаря водородным связям, молекулы воды в льду организуются в стабильную и регулярную структуру.
Таким образом, различие между льдом и водой состоит в структуре и взаимодействии их молекул. Водные молекулы, свободно двигаясь друг от друга, образуют жидкую фазу, в то время как вода, организованная в кристаллическую решетку льда, образует твердое вещество.
Теплота плавления и кристаллизации
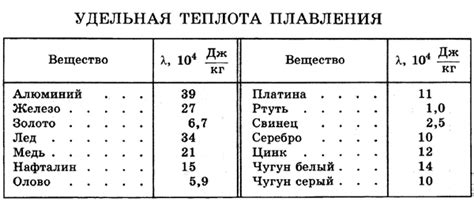
Теплота плавления – это количество теплоты, которое необходимо передать веществу для его перехода из твёрдого состояния в жидкое при постоянной температуре. Для льда, этот процесс начинается при температуре 0°C. В данной точке лёд и вода сосуществуют в равновесии.
Во время плавления, молекулы льда перестраиваются, формируя слабо связанный жидкий состав. Теплота плавления расталкивает молекулы друг от друга, позволяя им двигаться свободно и принимать жидкую форму.
Теплота кристаллизации, наоборот, является количеством теплоты, которое необходимо удалить от вещества для перехода из жидкого состояния в твёрдое состояние. При охлаждении жидкости, молекулы начинают образовывать регулярную кристаллическую структуру, благодаря чему возникает твёрдая фаза – лёд.
Таким образом, теплота плавления и кристаллизации являются ключевыми понятиями, объясняющими причины, по которым лёд и вода обладают разными физическими свойствами. Именно эти процессы позволяют льду быть твёрдым, а воде – жидкой, и придают им уникальные характеристики и применимость в различных областях нашей жизни.
Влияние давления и температуры
Давление и температура играют важную роль в определении физических свойств льда и воды. Изменение этих параметров может вызывать переход воды из одного состояния в другое.
Под воздействием давления лед может перейти в жидкое состояние. При давлении, превышающем нормальное атмосферное давление, лед начинает плавиться и превращается в воду. Это объясняет, почему на сильно сжатом льду возникает вода. Вода при этом остается в жидком состоянии даже при очень низких температурах.
Температура также имеет существенное влияние на состояние воды. При понижении температуры вода может переходить из жидкого состояния в твердое и образовывать лед. Этот процесс называется замерзанием. Каждая молекула воды имеет определенную энергию, которая зависит от ее температуры. Снижение температуры уменьшает энергию молекул, и они теряют движение, сближаясь между собой и образуя кристаллическую решетку льда.
Изменение давления или температуры может приводить к изменению состояния воды. Например, если лед подвергнуть давлению или нагреть, он начнет плавиться и превращаться в воду. И наоборот, если воду охладить или подвергнуть высокому давлению, она превратится в лед. Эти особенности льда и воды придают им уникальные физические свойства и являются причиной их различного состояния при разных условиях.



