Периодический закон химических элементов - один из фундаментальных принципов химии. Сформулированный впервые Дмитрием Ивановичем Менделеевым в 1869 году, этот закон отразил главное открытие в области химии: химические элементы, представленные в таблице Менделеева, упорядочены по возрастанию атомных номеров, а их химические и физические свойства повторяются периодически.
Однако формулировка периодического закона не осталась неизменной на протяжении всей его истории. Вплоть до наших дней ученые совершенствуют и уточняют его описание. Именно благодаря этим изменениям мы лучше понимаем физический смысл периодического закона и его связь с строением атомов и молекул.
Сама формулировка периодического закона Менделеева состояла в упорядочивании элементов в таблице, рассортированных по возрастанию атомных масс. Однако с развитием физической химии и квантовой механики стало ясно, что более фундаментальная основа для периодического закона - атомные номера, которые соответствуют количеству протонов в атоме. Это позволяет лучше объяснить связь между свойствами элементов и их строением.
Периодический закон и его изменение

Вначале, периодический закон был сформулирован Дмитрием Менделеевым, который разработал таблицу, известную как Периодическая система химических элементов. Эта таблица распределяла элементы по порядку их атомных номеров и группировала элементы с подобными химическими свойствами. С помощью этой таблицы, Менделеев смог предсказать свойства недостающих элементов и оставил пустые места для них в таблице.
Однако, после открытия электронной структуры атомов, физическое обоснование периодического закона было переосмыслено. Было обнаружено, что свойства химических элементов зависят от их электронной конфигурации, а не только атомного номера. Электроны в атомах располагаются на энергетических уровнях и подуровнях, образуя так называемую электронную оболочку. Величина и конфигурация электронной оболочки определяют химические свойства элемента.
Новое понимание периодического закона привело к изменению его формулировки. Сейчас он утверждает, что свойства химических элементов периодически меняются в соответствии с изменениями их электронной структуры. Таким образом, можно объяснить, почему элементы в одной группе таблицы имеют похожие свойства – у них одинаковое количество электронов на внешней энергетической оболочке.
Изменение формулировки периодического закона отражает углубление нашего понимания строения атомов и их взаимодействия. С помощью электронной структуры, мы можем объяснить не только химические свойства элементов, но и множество других явлений и процессов в химии. Периодический закон стал важнейшим инструментом для исследования и прогнозирования химических реакций и свойств веществ.
Формулирование периодического закона

Первой попыткой формулирования периодического закона была работа российского химика Дмитрия Ивановича Менделеева, представленная в 1869 году. Менделеев предложил систему классификации химических элементов, которая позволяла упорядочить их в таблицу, называемую периодической системой элементов.
Менделеев разместил элементы в порядке возрастания атомных масс и расположил их в горизонтальные строки, называемые периодами. Каждый период начинался с щелочного металла и заканчивался инертным газом. Вертикальные столбцы таблицы представляли собой группы элементов с аналогичными химическими свойствами.
Важной особенностью таблицы Менделеева было наличие пустых мест, которые подразумевали существование еще неизвестных элементов. Менделеев смог предсказать свойства этих элементов, а затем они были обнаружены и были названы в честь Менделеева.
Таким образом, формулирование периодического закона Менделеевым в значительной степени изменило взгляд на химические элементы и их свойства. Он создал систему, которая позволяла классифицировать элементы по их атомным номерам и предсказывать свойства еще неизвестных элементов. Периодический закон стал основой для дальнейших исследований и развития в области химии.
Исторический контекст изменений

Периодический закон, описывающий закономерности в химических свойствах элементов, развивался на протяжении многих лет и прошел через несколько изменений в своем формулировании и физическом смысле.
В начале 19 века, когда основные химические элементы были известны и распределены в таблице, Генри Главерсон провел исследования, чтобы найти закономерности в их свойствах. Он заметил, что элементы с похожими химическими свойствами имеют похожую атомную массу. На основе этого наблюдения, Главерсон сформулировал предшественник периодического закона, но его идеи были оставлены незавершенными из-за недостатка данных и систематических исследований.
В 1869 году, русский химик Дмитрий Менделеев разработал первую версию периодической таблицы элементов на основе атомной массы и химических свойств. Он организовал элементы в порядке возрастания атомной массы и оставил пустые места для элементов, которые еще не были открыты. Это позволило Менделееву предсказать свойства и характеристики неизвестных ему элементов. Таким образом, Менделеев ввел систематику в организацию элементов и установил основу для последующего развития периодического закона.
В 1913 году, независимо от Менделеева, английский физик Генри Моузли открыл, что основное свойство элементов, которое определяет их позицию в периодической таблице, является их атомное число. Он предложил модель атома, в которой электроны расположены в энергетических уровнях вокруг ядра и установил, что позиция элемента в периодической таблице зависит от количества электронов в его внешней оболочке. Это познание дало новый физический смысл периодическому закону и позволило уточнить его формулирование.
С течением времени и развитием физики и химии, формулировка периодического закона и его физический смысл продолжили уточняться. Внесение данных о распределении электронов в атомах и структуре атомного ядра позволило создать более точные модели атома и объяснить многие закономерности в химических свойствах элементов.
Современная версия периодического закона основывается на понятии атомного номера, которое является числовым значением, определяющим положение элемента в периодической таблице. Формулировка закона включает понятия периодов (горизонтальные строки в таблице) и групп (вертикальные столбцы), а также связь между расположением элементов и их физическими и химическими свойствами.
Периодический закон и таблица Менделеева
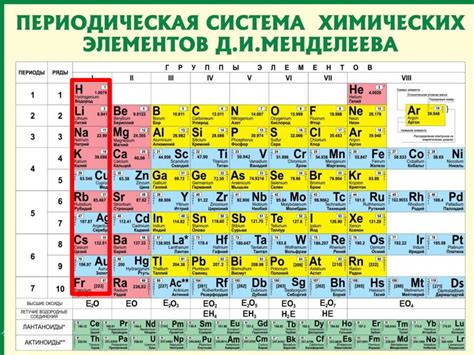
Периодический закон формулирует основные закономерности химических свойств элементов и их атомных масс. Развитие этого закона было связано с созданием таблицы Менделеева, которая отражает периодическую закономерность химических элементов и стала одним из самых важных достижений в области химии.
В таблице Менделеева элементы упорядочены по возрастанию их атомных номеров, которые соответствуют количеству протонов в атоме элемента. Элементы распределены в таблице в периоды (горизонтальные строки) и группы (вертикальные столбцы) в зависимости от химических свойств и строения атомов. Нумерация периодов в таблице соответствует энергетическим уровням электронной оболочки атомов.
Таблица Менделеева обладает значительным физическим смыслом, так как по ней можно анализировать и предсказывать химические свойства элементов, а также находить закономерности между ними. Она позволяет систематизировать огромное количество информации о химических элементах и делает упорядочение и изучение химических свойств элементов более удобным и доступным.
При создании таблицы Менделеева, он оставил свободные места под элементы, чьи свойства еще не были известны, и смог предсказать неизвестные в то время элементы и их свойства. Это подтвердило адекватность периодического закона и достоверность таблицы Менделеева.
Таким образом, периодический закон и таблица Менделеева являются важнейшими элементами химической науки, которые позволяют понять и классифицировать свойства химических элементов и предсказывать новые свойства еще неизвестных элементов.
Количественные параметры периодического закона

В различные периоды и группы таблицы Менделеева включаются элементы с аналогичными химическими свойствами. Период - это горизонтальный ряд элементов на таблице, который определяется количеством электронных оболочек в атоме. Группа - это вертикальный столбец элементов, у которых одинаковое количество электронов на внешней энергетической оболочке.
Периодический закон выражается через следующие количественные параметры:
| Параметр | Описание |
|---|---|
| Атомный номер (Z) | Указывает на порядковый номер элемента в таблице Менделеева. Значение атомного номера определяет количество протонов в ядре атома и равно количеству электронов в нейтральном атоме. |
| Относительная атомная масса (A) | Показывает среднюю массу атома элемента, учитывая все его изотопы. Она рассчитывается как сумма произведений массы каждого изотопа на его относительную молекулярную долю. |
| Периодическая система | Таблица Менделеева, в которой элементы расположены по возрастанию атомного номера и организованы в периоды и группы в соответствии с их химическими свойствами. |
Эти количественные параметры позволяют легко классифицировать и анализировать элементы в таблице Менделеева, выявлять закономерности и установить взаимосвязь между различными физико-химическими свойствами элементов.
Периодический закон играет важную роль в химии и физике, позволяя предсказывать и объяснять реактивность элементов, строить модели атомов, разрабатывать новые материалы и проводить исследования в различных областях науки и техники.
Расширение понятия периодического закона

Однако с течением времени и с углублением исследований в области химии, понятие периодического закона стало более сложным и включает в себя не только закономерности в свойствах элементов, но и их взаимосвязь с атомной структурой и электронным строением.
Современное понимание периодического закона основано на концепции электронной конфигурации атомов. Оно утверждает, что свойства элементов повторяются периодически, и их поведение можно объяснить на основе расположения электронов в атомах. Периодический закон тесно связан с расположением элементов в периодической системе Менделеева и представляет собой способ классификации и систематизации химических элементов.
Суть периодического закона заключается в том, что свойства элементов изменяются по мере движения от одной группы к другой: металлы, неметаллы, полуметаллы; от одного периода к другому: от горизонтальных рядов вверх или вниз по таблице Менделеева. Это изменение свойств, как величины, так и химического поведения, является следствием изменяющегося строения вязчайших копаниц электронов.
Расширение понятия периодического закона включает в себя не только закономерности в свойствах элементов, но и объясняет эти закономерности на основе их атомной структуры и электронного строения, что делает его более глубоким и полным с точки зрения описания поведения химических элементов и соединений.
Современное понимание физического смысла закона

Современное понимание физического смысла периодического закона основано на развитии теории атомного строения вещества и квантовой механики.
Современное понимание закона связано с расположением электронных оболочек в атомах элементов. Имеется несколько периодов, каждый из которых представляет собой новую электронную оболочку, обладающую своими характеристиками. Внутри каждого периода располагаются подуровни, которые определяют возможные энергетические состояния электронов.
Периодический закон позволяет прогнозировать свойства элементов и их соединений. Так, элементы одной группы имеют похожие химические свойства, потому что в их атомах содержится одинаковое количество электронов в валентной оболочке. Следовательно, они могут образовывать аналогичные химические связи.
Физический смысл закона состоит в установлении связи между строением атомов и их химическими и физическими свойствами. Периодическая система химических элементов помогает упорядочить и систематизировать огромное множество различных веществ и предсказывать их химическое поведение.
Влияние периодического закона на науку и технологии

Периодический закон, сформулированный Д.И. Менделеевым в конце XIX века, оказал огромное влияние на развитие науки и технологий. Этот закон состоит в том, что химические элементы могут быть упорядочены в таблицу, называемую периодической, в которой они располагаются по возрастанию атомных номеров и схожим химическим свойствам. Такая систематизация элементов позволила установить закономерности и тенденции в их химическом поведении и свойствах.
Периодический закон стал основой для дальнейших исследований в области химии и физики элементов. Он стал фундаментальным понятием, на котором строятся многие теории и модели, а также позволил предсказывать новые элементы и их свойства. Массивные исследования в области периодического закона привели к открытию новых элементов, таких как гелий, гафний, ренний, искусственных радиоактивных элементов и других.
Благодаря периодическому закону была создана система классификации и нумерации химических элементов, что упростило их изучение и использование в различных областях науки и технологий. Систематическая организация элементов дала возможность исследователям проводить комплексные и сравнительные анализы, разрабатывать и улучшать различные химические реакции и процессы.
Периодический закон оказал влияние не только на химию, но и на другие научные дисциплины и технологии. Он стал основой для развития областей, таких как физика атомных ядер и физика элементарных частиц. Исследования в этих областях привели к открытию новых элементарных частиц и новых физических явлений. Также периодический закон нашел применение в материаловедении, химической промышленности, фармацевтике и других направлениях технологий.
В целом, периодический закон имеет огромное значение в различных областях науки и технологий. Он позволяет понять и предсказывать поведение и свойства элементов, что способствует развитию новых материалов, технологий и научных открытий. Благодаря периодическому закону ученые смогли расширить свое понимание строения и взаимодействия микромира и макромира, что привело к совершенствованию нашего мира и улучшению условий жизни.



