Гибридизация атомов углерода – это фундаментальное понятие в органической химии, которое играет важную роль в определении структуры и свойств органических соединений. Гибридизация атомов углерода представляет собой процесс, при котором электронные орбитали атома углерода переорганизуются для образования новых гибридных орбиталей с определенной формой и энергией.
Гибридизация атомов углерода позволяет объяснить форму и геометрическую структуру многих органических соединений. Гибридные орбитали атомов углерода обеспечивают определенное пространственное расположение связей и атомов в молекуле, что влияет на ее химические и физические свойства. Например, гибридизация атомов углерода может определить, будет ли молекула плоской или трехмерной. Также, гибридизация атомов углерода определяет систему связей и способствует образованию различных функциональных групп в молекуле.
Понимание гибридизации атомов углерода является ключевым для изучения органической химии и позволяет предсказать и объяснить реакционные механизмы, молекулярную геометрию и химические свойства органических соединений. Знание о гибридизации также позволяет разрабатывать новые методы синтеза органических соединений и создавать новые материалы с определенными свойствами для применения в различных областях, таких как фармацевтика, материаловедение и нанотехнологии.
Гибридизация атомов углерода: определение и значение
В органических соединениях углерод играет центральную роль, так как способность атома углерода образовывать четыре связи позволяет ему создавать разнообразные молекулы. Гибридизация атомов углерода определяет форму и стереохимические свойства органических соединений.
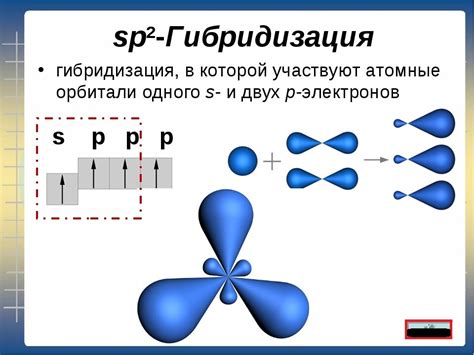
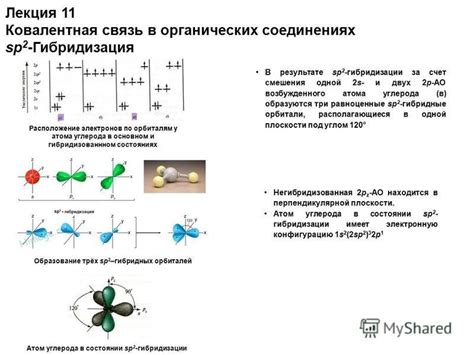
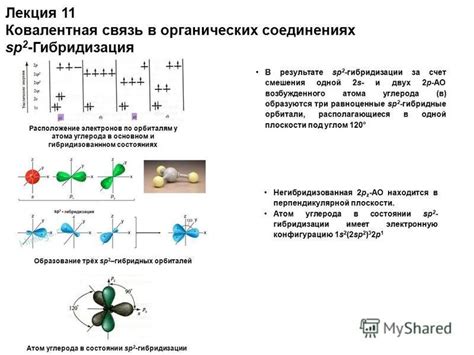
Гибридизация атомов углерода подразделяется на несколько типов, таких как гибридизация sp, sp2 и sp3, которые соответствуют различным электронным орбиталям. Гибридизация sp предполагает комбинацию одной s- и одной p-орбитали, образуя две гибридные орбитали, поэтому атом углерода может образовывать двойные связи. Гибридизация sp2 происходит при комбинации одной s- и двух p-орбиталей, что позволяет атому углерода образовывать тройные связи. Гибридизация sp3 возникает при комбинации одной s- и трех p-орбиталей, образуя четыре гибридные орбитали, позволяющие атому углерода образовывать четыре одинарные связи.
Разнообразие гибридных состояний атомов углерода определяет способность органических молекул к образованию различных типов связей и подтверждает их химическую реакционную активность. Правильное понимание и определение гибридизации атомов углерода необходимо для понимания структуры и свойств органических соединений, и имеет важное значение в синтезе новых соединений и разработке лекарственных препаратов.
Таким образом, гибридизация атомов углерода является ключевым понятием в органической химии, определяющим форму и свойства органических соединений, и играет важную роль в науке и промышленности.
Значение гибридизации атомов углерода в органических соединениях
Гибридизация атомов углерода позволяет иметь различные геометрические формы, такие как линейные, треугольные и плоские. Это влияет на взаимодействие атомов углерода с другими атомами в молекулах и обуславливает возможность образования различных связей.
Примеры гибридизации атомов углерода можно найти во множестве органических соединений, таких как углеводороды, амины, карбоновые кислоты и др. Гибридизация атомов углерода обуславливает их способность образовывать множество разных химических соединений с различными свойствами и реакционной активностью.
Понимание гибридизации атомов углерода в органических соединениях является необходимым для изучения молекулярной структуры и свойств органических соединений. Это знание позволяет предсказывать химическую активность молекул, взаимодействие с другими веществами и объяснять особенности их свойств и реакций.
Принципы гибридизации атомов углерода

Гибридизация атомов углерода возникает в результате перераспределения электронов в его энергетических оболочках, что приводит к образованию гибридных орбиталей. Эти гибридные орбитали позволяют атому углерода образовывать ковалентные связи с другими атомами в органических соединениях.
Существуют несколько принципов гибридизации атомов углерода:
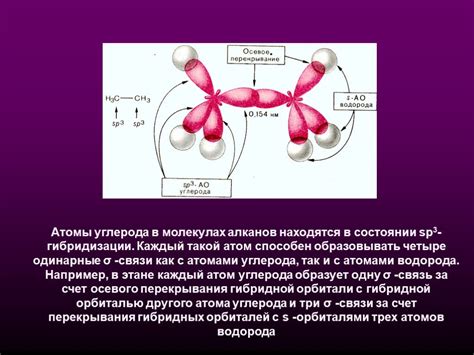
- Сп^3-гибридизация: атом углерода образует 4 гибридные орбитали, расположенные в форме тетраэдра. Этот тип гибридизации характерен для атомов углерода в метане и других алканах.
- Сп^2-гибридизация: атом углерода образует 3 гибридные орбитали и одну p-орбиталь. Гибридные орбитали плоско располагаются в форме треугольника, в то время как p-орбиталь ориентирована перпендикулярно плоскости. Этот тип гибридизации характерен для атомов углерода в алкенах и ароматических соединениях.
- Сп-гибридизация: атом углерода образует 2 гибридные орбитали и две p-орбитали. Гибридные орбитали линейно располагаются, а p-орбитали ориентированы перпендикулярно гибридным орбиталям. Этот тип гибридизации характерен для атомов углерода в алкинах.
Важно отметить, что гибридизация атомов углерода позволяет органическим соединениям обладать разнообразием свойств и химических реакций, что открывает широкие возможности для синтеза и применения органических соединений в различных областях науки и промышленности.
Основные типы гибридизации атомов углерода

1. Четырехвалентная гибридизация (sp3). В этом типе гибридизации атом углерода образует четыре электронные области, что позволяет молекуле быть тетраэдрической или плоскостью треугольника. Примерами молекул с четырехвалентной гибридизацией являются метан (CH4) и этилен (C2H4).
2. Трехвалентная гибридизация (sp2). В этом случае атом углерода образует три электронные области, образуя плоскую треугольную структуру. Рассмотрим молекулу этилена (C2H4): каждый углеродный атом соединен с двумя атомами водорода и одним другим атомом углерода. Этот тип гибридизации обеспечивает наличие двойной связи и позволяет молекуле иметь плоскую геометрию.
3. Двухвалентная гибридизация (sp). Данный тип гибридизации характерен для молекул, содержащих тройные связи. Например, ацетилен (C2H2) имеет двухвалентную гибридизацию углеродных атомов, которая обеспечивает наличие тройной связи и линейную геометрию молекулы.
Знание и понимание основных типов гибридизации атомов углерода является важным для изучения и анализа органических соединений. Эти типы гибридизации определяют формулы и структуры молекул, и помогают предсказывать и объяснять их физические и химические свойства. Разнообразие гибридизаций углерода позволяет органической химии быть настолько разнообразной и интересной наукой.
Свойства и химическая активность гибридизированных атомов углерода

Гибридизация атомов углерода в органических соединениях играет важную роль в их свойствах и химической активности. Гибридизированный атом углерода обладает определенными свойствами, которые определяют его химическую активность и способность участвовать в реакциях.
Самым распространенным типом гибридизации атомов углерода является сп3-гибридизация, при которой электронные орбитали атома углерода комбинируются для образования четырех гибридных орбиталей. За счет этой гибридизации, атом углерода становится способным образовывать четыре ковалентные связи с другими атомами, что позволяет ему образовывать разнообразные соединения.
Гибридизированные атомы углерода обладают следующими свойствами:
1. Способность к образованию ковалентных связей: Гибридизация атомов углерода позволяет им образовывать ковалентные связи с другими атомами, включая атомы углерода, азота, кислорода и многие другие элементы. Это свойство определяет возможность образования огромного многообразия органических соединений.
2. Стабильность связей: Гибридизированные атомы углерода образуют ковалентные связи, которые являются стабильными и обладают значительной прочностью. Это обусловлено силой ковалентных связей и геометрией молекул, которая определяется гибридизацией.
3. Реакционная способность: Гибридизированные атомы углерода обладают определенной химической активностью и могут участвовать в реакциях, таких как синтез и разложение органических соединений. Они могут изменяться и образовывать новые связи с другими атомами, что позволяет создавать различные классы органических соединений.
Таким образом, свойства и химическая активность гибридизированных атомов углерода являются важными для понимания органической химии и имеют значительное значение в многих областях науки и промышленности.
Примеры гибридизации атомов углерода в органических соединениях
Гибридизация атомов углерода играет важную роль в органической химии, и в результате этого процесса атомы углерода могут образовать различные гибридные орбитали, что влияет на их способность образовывать связи с другими атомами.
Ниже приведены несколько примеров гибридизации атомов углерода в органических соединениях:
- Гибридизация sp3:
- Метан (CH4): в этом соединении каждый атом углерода образует четыре одинаковых связи с атомами водорода, используя четыре гибридных орбитали sp3.
- Этан (C2H6): здесь каждый атом углерода также образует четыре связи, но одна из них является двойной связью между двумя атомами углерода.
- Гибридизация sp2:
- Этен (C2H4): в этом соединении каждый атом углерода образует три связи с атомами водорода и одну двойную связь между собой, используя три гибридных орбитали sp2.
- Бензол (C6H6): здесь шесть атомов углерода образуют кольцо, каждый из которых образует три связи с соседними атомами углерода и одну связь с атомами водорода. Гибридизация sp2 позволяет атому углерода находиться в одной плоскости с другими атомами кольца, обеспечивая плоскую структуру бензола.
- Гибридизация sp:
- Этилен (C2H2): в этом соединении каждый атом углерода образует две связи с атомами водорода и одну тройную связь между собой, используя две гибридных орбитали sp.
- Ацетилен (C2H2): здесь два атома углерода связаны тройной связью, а каждый атом образует еще одну связь с атомами водорода.
Это лишь несколько примеров, и в органической химии существует множество других соединений, в которых гибридизация атомов углерода играет важную роль. Понимание гибридизации позволяет ученым прогнозировать структуру и свойства органических соединений и использовать их в различных промышленных и медицинских приложениях.
Импортантность гибридизации атомов углерода для синтеза органических соединений

При гибридизации атом углерода пересчитывает свои электроны и изменяет структуру своей оболочки. Это позволяет атому углерода образовывать четыре одинаковых по качеству и силе связи, так называемых σ-связи. Гибридизация также обеспечивает определенную геометрическую форму молекулы, которая имеет прямое влияние на ее свойства.
Главное значение гибридизации атомов углерода заключается в возможности создания различных классов органических соединений с разной химической активностью и химической структурой. Наличие разных типов гибридизации углерода, таких как $sp^3$, $sp^2$ и $sp$, позволяет образовывать двух-, трех- и четырехкоординированные соединения, соответственно.
Способность углерода образовывать π-связи, также зависит от гибридизации. Гибридизация $sp^2$ позволяет образовать π-связи в плоскости молекулы, что делает возможным образование двойных связей. Гибридизация $sp$ позволяет образовывать π-связи в плоскости и перпендикулярно ей, что позволяет образованию тройных связей.
Таким образом, гибридизация атомов углерода играет фундаментальную роль в синтезе органических соединений, позволяет создавать разнообразные молекулы с различными свойствами и химической активностью. Понимание процесса гибридизации и его влияния на структуру и свойства органических соединений является ключевым для развития современной органической химии и применения органических соединений в различных областях науки и промышленности.
Гибридизация атомов углерода в биологически активных молекулах
В биологически активных молекулах, таких как лекарственные препараты, антибиотики и ферменты, гибридизация атомов углерода играет важную роль в определении их взаимодействия с биологическими мишенями. Гибридизация атомов углерода влияет на геометрию молекулы, а следовательно, на ее молекулярное взаимодействие с другими биомолекулами.
Наиболее распространенной гибридизацией атомов углерода в биологически активных молекулах является сп^3-гибридизация, при которой атом углерода образует четыре одинаковых σ-связи с другими атомами. Обычно эти атомы являются атомами водорода, кислорода, азота или другими атомами углерода. Эта гибридизация способствует образованию трехмерной структуры молекулы и обеспечивает ее пространственную гибкость, что часто критично для ее взаимодействия с биологическими мишенями.
Другой распространенной гибридизацией атомов углерода в биологически активных молекулах является сп^2-гибридизация. На этой стадии атом углерода образует три σ-связи с другими атомами, и угол между плоскими плоскостями этих связей составляет 120 градусов. Это свойство гибридизации влияет на плоскость молекулы и способствует ее ароматичности и конъюгированию, что может быть важно для ее влияния на биологические процессы.
Понимание гибридизации атомов углерода в биологически активных молекулах помогает исследователям предсказывать и понимать их биологическую активность и взаимодействие с живыми системами. Это позволяет разрабатывать новые лекарственные препараты, антибиотики и другие биологически активные соединения с желаемыми свойствами и эффективностью.
| Гибридизация | Количество σ-связей с атомами углерода | Угол между связями | Примеры |
|---|---|---|---|
| sp^3 | 4 | 109.5 градусов | метан (CH4), этилен (C2H4) |
| sp^2 | 3 | 120 градусов | бензол (C6H6), этилен (C2H4) |
Заключительные мысли о гибридизации атомов углерода в органических соединениях
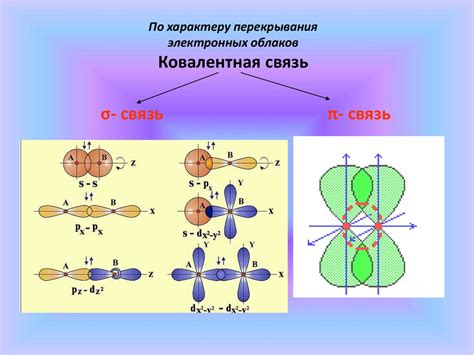
Гибридизационные состояния атомов углерода, такие как $sp^3$, $sp^2$ и $sp$, определяют свойства соединений, такие как геометрию молекулы, длины и углы связей, силы взаимодействий и реакционную активность. Например, в $sp^3$-гибридизации атом углерода образует четыре связи с другими атомами или группами атомов, что приводит к образованию тетраэдрической геометрии. На другом конце спектра гибридизации, при $sp$-гибридизации углерод образует две связи и имеет линейную геометрию.
Понимание гибридизации атомов углерода позволяет химикам предсказывать свойства и поведение органических соединений, основываясь на их структуре. Это позволяет разрабатывать новые соединения с определенными свойствами и улучшать существующие процессы лигирования, катализа и синтеза.
Таким образом, гибридизация атомов углерода является основой органической химии и играет важную роль в понимании и развитии этой науки. Ее изучение помогает раскрыть тайны устройства и функционирования органических соединений и создать новые материалы и технологии, которые способствуют развитию нашей современной жизни.