Белки - это основные структурные элементы живых организмов, выполняющие огромное количество функций, начиная от катализа химических реакций и заканчивая передачей сигналов в клетке. Их функциональность обусловлена их уникальной структурой, которая подвержена непрерывным изменениям. Белковая конформация, то есть пространственная структура белка, может меняться под воздействием различных факторов и условий.
Главной причиной лабильности белковой конформации является их высокая гибкость и подвижность. Белок состоит из цепи аминокислот, связанных между собой пептидными связями. Интересно, что даже простейшая белковая молекула может иметь сотни и тысячи аминокислотных остатков, что делает их пространственную структуру очень сложной и гибкой.
Влияние на конформацию белка оказывают различные факторы, такие как pH среды, температура, наличие специфических лигандов и другие молекулы. Механизмы изменения конформации могут быть разнообразными: от изменения связей внутри белковой молекулы до изменения ее взаимодействия с другими молекулами.
Белкам необходима гибкость

Гибкость белков играет важную роль в их функционировании. Она позволяет белкам адаптироваться к различным условиям среды и выполнять свои функции эффективно. Гибкость позволяет белкам взаимодействовать с другими молекулами, передвигаться, изменять свою форму и структуру.
Гибкость белков обеспечивается специальными участками - дисордерами или междоменными элементами, которые не имеют жесткой конформации. Они могут принимать разные положения и углы, что позволяет белкам выполнять свои функции.
Более того, лабильность белковой конформации является основой для возможной регуляции и контроля функций белков в организме. Изменение конформации белков может привести к различным эффектам и функциям, что позволяет организму адаптироваться к изменяющимся условиям.
Таким образом, гибкость и лабильность белковой конформации играют важную роль в функционировании организмов, позволяя белкам выполнять свои функции эффективно и адаптироваться к изменениям внешней среды.
Молекулярные взаимодействия

Молекулярные взаимодействия играют важную роль в определении конформации белков. Белки состоят из длинных цепочек аминокислот, которые связываются друг с другом через различные типы молекулярных взаимодействий.
Одним из наиболее значимых типов взаимодействий является водородная связь. Водородные связи образуются между атомами водорода и электронодонорными атомами, такими как атомы кислорода, азота и серы. Эти связи обеспечивают стабильность и пространственную ориентацию структурных элементов белковой молекулы.
Еще одним важным типом взаимодействия является взаимодействие гидрофобных частей белка. Гидрофобные аминокислоты имеют тенденцию образовывать кластеры, чтобы минимизировать контакт с водой. Эти внутренние гидрофобные взаимодействия способствуют формированию компактных структур белка.
Также, электростатические взаимодействия, такие как взаимодействие соль-диполь и взаимодействие соль-ион, могут оказывать влияние на стабильность белковой конформации. Эти взаимодействия зависят от заряда и распределения зарядов в белковой молекуле.
Кроме того, белки могут взаимодействовать с другими молекулами, такими как липиды или другие белки. Эти взаимодействия способны изменять конформацию белков и оказывать влияние на их функцию.
Таким образом, молекулярные взаимодействия играют критическую роль в определении конформации белков. Благодаря их лабильности, белки могут изменять свою форму и адаптироваться к различным условиям окружающей среды, что позволяет им выполнять разнообразные биологические функции.
Влияние окружающей среды

Окружающая среда играет важную роль в формировании и стабильности белковой конформации. Белковые молекулы находятся в постоянном взаимодействии с окружающими их факторами, такими как температура, pH, соли, растворители и другие молекулы.
Изменения в окружающей среде могут привести к нарушению конформации белка и, соответственно, его функции. Например, повышение температуры может привести к денатурации белков, при которой структура белка разрушается, что приводит к потере его функциональности.
Также, окружающая среда может влиять на связывание и распад белковых комплексов. Изменение pH или добавление растворителей может повлиять на заряженность и гидрофобность белка, что в свою очередь может изменить его взаимодействия с другими белками или молекулами.
Окружающая среда также может предоставлять белкам дополнительные молекулярные поверхности или стимулировать определенные конформационные переходы. Например, наличие специфических ионов или лигандов может модулировать активность белка и облегчить его связывание с другими молекулами.
Все эти факторы делают белковую конформацию лабильной и чувствительной к изменениям в окружающей среде. Понимание этих взаимодействий является важным шагом в изучении структуры и функции белков, а также в разработке новых лекарственных препаратов и технологий.
Термодинамическая нестабильность

Белковые молекулы состоят из цепочек аминокислот, которые связаны между собой пептидными связями. Каждая аминокислота имеет свои уникальные свойства, такие как заряд, гидрофобность или гидрофильность. Эти свойства могут влиять на пространственное расположение аминокислот внутри белковой молекулы и способствовать изменению конформации.
Помимо внутренних свойств аминокислот, белковую конформацию также могут влиять внешние факторы, такие как температура, pH-уровень, наличие химических реагентов и другие. Эти факторы могут вызывать изменения во внутренней структуре белка, что приведет к изменению его конформации.
Термодинамическая нестабильность белковой конформации также связана с энергетическими потерями и неустойчивостью связей внутри молекулы. Слабые связи, такие как водородные связи и гидрофобные взаимодействия, держат белковую структуру вместе. Однако эти связи легко нарушаются из-за колебаний атомов и молекул, что ведет к изменению конформации белковой молекулы.
Таким образом, термодинамическая нестабильность обусловлена сложной внутренней структурой белков и их взаимодействием с окружающей средой. Это делает белковую конформацию лабильной и способствует ее постоянным изменениям.
Активность белка
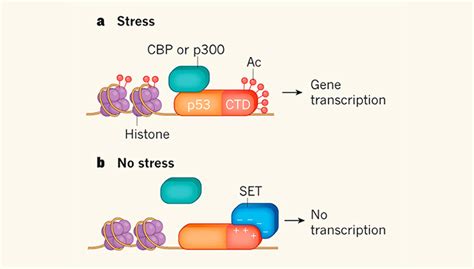
В связи с лабильностью белковой конформации, активность белка может быть изменена под влиянием различных факторов. Эти факторы могут включать изменения pH, температуры, наличие кофакторов, взаимодействие с другими молекулами и пр. Эти изменения могут привести к изменению структуры белка и, в свою очередь, изменению его активности.
Некоторые белки являются ферментами, катализирующими химические реакции. Они могут изменять конформацию, чтобы принять своего субстрата и совершить реакцию. Такие белки обладают специфичностью и эффективностью действия, которые обеспечивают определенные активные участки с определенными аминокислотными остатками.
Другие белки могут иметь способность связывать молекулы или структурные компоненты. Например, белки-связывающие белки могут связываться с определенными генетическими последовательностями и регулировать экспрессию генов. Это позволяет белкам участвовать в регуляции биологических процессов.
Таким образом, активность белка зависит от его конформации, которая может быть изменена под влиянием различных факторов. Понимание этих механизмов изменения белковой активности является важным аспектом в изучении биологических процессов и поиске лекарственных средств.
Распределение зарядов и электростатические взаимодействия
Заряд внутри белка обусловлен наличием атомов, которые могут быть положительно или отрицательно заряжены в зависимости от наличия или отсутствия лишних или недостающих электронов. Такое распределение зарядов влияет на пространственное положение атомов и молекул внутри белка.
| Положительные заряды | Отрицательные заряды |
|---|---|
| Лизин | Глутамат |
| Аргинин | Аспартат |
| Гистидин | Глютаминовая кислота |
Электростатические взаимодействия возникают между зарядами разных знаков и могут притягивать или отталкивать атомы и молекулы внутри белка. Эти взаимодействия могут изменяться в результате внешних факторов, таких как изменение pH среды или наличие специфических молекул.
Электростатические взаимодействия способствуют гибкости и лабильности белковой конформации. Благодаря таким взаимодействиям белки могут изменять свою форму для взаимодействия с другими молекулами и выполнять свои функции в организме.
Регуляция активности и конформации
Лабильность белковой конформации обеспечивает их гибкость и способность принимать различные структурные состояния. Благодаря этому, белки могут выполнять свои функции в условиях постоянно меняющейся среды.
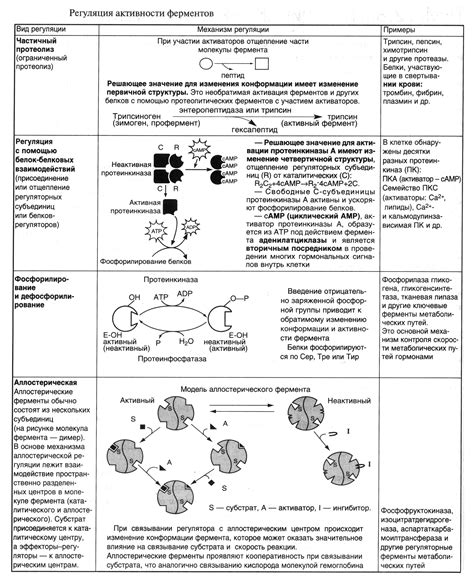
Регуляция активности белков может осуществляться через изменение их конформации при взаимодействии с другими молекулами, такими как лиганды или фосфатные группы. Эти взаимодействия могут вызывать конформационные изменения, которые могут повлиять на активность белка.
Вмешательство других белков в конформацию также может служить механизмом регуляции. Например, белки-шапероны могут помогать в правильной сворачивании и сборке других белков, а транскрипционные факторы могут изменять конформацию белок-или ДНК, что влияет на их взаимодействие.
Также важную роль в регуляции играют пост-трансляционные модификации, такие как фосфорилирование, гликозилирование или ацетилирование, которые могут изменить конформацию белка и его активность.
В целом, лабильность белковой конформации позволяет им эффективно функционировать внутри клетки и взаимодействовать с другими молекулами. Регуляция активности и конформации белков играет важную роль в поддержании равновесия и нормального функционирования организма.