Химическое равновесие – одно из фундаментальных понятий в химии, описывающее состояние системы, в которой процессы протекают в обоих направлениях с одинаковой скоростью. Однако, в некоторых случаях необходимо изменить равновесие в нужную сторону, чтобы достичь желаемого результата. Катализаторы – это вещества, которые могут помочь ускорить химические реакции и изменить химическое равновесие в сторону образования большего количества продукта или реагента.
Катализаторы воздействуют на химическую реакцию путем снижения энергии активации, не изменяя при этом своего состава. Они участвуют в реакции, образуя промежуточные состояния, которые позволяют более эффективно переходить от исходных веществ к конечным продуктам. В результате использования катализатора, химическая реакция может протекать с большей скоростью и при более низких температурах, что значительно экономит энергию и ресурсы.
Эффективность катализатора зависит от ряда факторов, таких как его активность и специфичность к реакциям, а также условия реакции, включая температуру, давление и концентрацию реагентов. Катализаторы могут быть гомогенными, то есть находиться в одной фазе с реагентами, или гетерогенными, когда они находятся в другой фазе – например, в растворе, в суспензии или на поверхности твердого вещества. Гетерогенные катализаторы, такие как металлические катализаторы или ферменты, обладают особенно высокой эффективностью и широким применением в промышленности и научных исследованиях.
Катализаторы: как изменяют химическое равновесие в реакциях

Катализаторы играют важную роль в химических реакциях, позволяя ускорить их протекание и изменить химическое равновесие. Они способны влиять на скорость реакции, уменьшая энергию активации и позволяя процессу протекать при низких температурах и без дополнительного внешнего воздействия.
Принцип работы катализатора заключается в создании особой среды, в которой реагенты могут взаимодействовать более интенсивно и эффективно. Он может изменять концентрацию реагентов в равновесной системе, снижая ее и вызывая перемещение равновесия в сторону преобразования большего количества продуктов. Кроме того, катализатор может изменять путь реакции, образуя промежуточные соединения и облегчая проход через энергетические барьеры.
Для понимания роли катализатора в изменении равновесия реакции можно представить его как посредника между реагентами и продуктами, который создает условия для более эффективного и быстрого протекания реакции.
| Преимущества использования катализаторов: |
|---|
| 1. Увеличение скорости химической реакции; |
| 2. Снижение температурных условий протекания реакции; |
| 3. Снижение затрат на производство; |
| 4. Увеличение выхода продукции; |
| 5. Высокая степень утилизации реактивов; |
| 6. Более экологически чистые технологии. |
Выбор катализатора для определенной реакции зависит от различных факторов, таких как тип реакции, реагенты, условия и механизм реакции. Существует множество катализаторов различных классов и областей применения, каждый из которых имеет свои особенности и преимущества.
Таким образом, использование катализаторов является важным методом в изменении химического равновесия и повышении эффективности химических процессов. Они позволяют ускорить реакции, снизить энергетические затраты и получить большее количество продукции. Катализаторы играют ключевую роль в современной промышленности и научных исследованиях, обеспечивая развитие новых технологий и повышение экономической и экологической эффективности процессов.
Принципы работы катализаторов
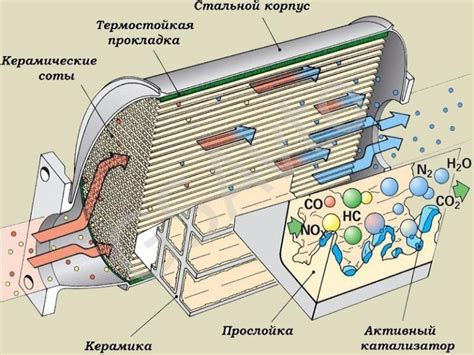
Катализаторы участвуют в реакции, образуя промежуточные соединения с реагентами. Эти промежуточные соединения обладают более низкой энергией активации, что позволяет реагентам более легко превратиться в продукты. Поэтому катализаторы повышают скорость химической реакции, ускоряя направление процесса.
Одна из основных принципиальных особенностей катализаторов заключается в том, что они регенерируются после завершения реакции. Это означает, что они могут использоваться повторно и оказывать влияние на большое количество реакций.
Катализаторы могут работать по разным механизмам. Некоторые катализаторы, такие как гомогенные катализаторы, находятся в одной фазе с реагентами. Другие катализаторы, такие как гетерогенные катализаторы, находятся в отдельной фазе. Однако, независимо от механизма действия, катализаторы способствуют увеличению скорости реакции и снижению энергии активации.
Выбор катализатора является важным аспектом химической реакции. Разные катализаторы могут проявлять эффективность в разных реакциях, поэтому необходимо подбирать наиболее подходящий катализатор в каждом конкретном случае. Кроме того, разработка новых катализаторов и поиск более эффективных способов катализа являются активно исследуемыми направлениями в современной химии.
Классификация катализаторов
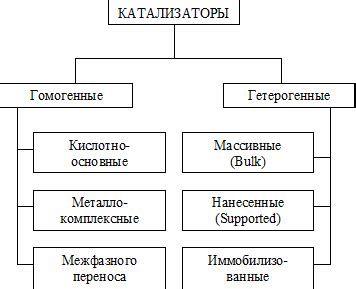
Катализаторы могут быть классифицированы по разным признакам, включая химическую природу, физическую структуру и механизм воздействия. Вот некоторые основные классы катализаторов:
Гетерогенные катализаторы. Этот класс катализаторов является наиболее распространенным и включает в себя катализаторы, которые находятся в различной фазе с реагентами. Гетерогенные катализаторы обычно представляют собой твердые материалы, такие как металлы, оксиды, карбиды и другие соединения. Они обеспечивают поверхность, на которой происходят химические реакции.
Гомогенные катализаторы. В отличие от гетерогенных катализаторов, гомогенные катализаторы находятся в той же фазе, что и реагенты. Они обычно представляют собой растворы, в которых молекулы катализатора и реагентов взаимодействуют между собой.
Ферменты. Ферменты являются биологическими катализаторами, которые обычно находятся внутри клеток живых организмов. Они играют важную роль в большинстве биохимических процессов, ускоряя реакции и помогая поддерживать биологическое равновесие.
Энзимы. Энзимы - одна из подклассов ферментов, которые специализируются на конкретных химических реакциях. Они обычно имеют сложную структуру и могут быть очень специфичными, выбирая только определенные реагенты.
Выбор катализатора зависит от конкретной реакции и условий проведения. Различные классы катализаторов имеют свои преимущества и ограничения, и поэтому выбор должен быть основан на требованиях процесса.
Роль катализатора в изменении химического равновесия

Здесь на сцену выходит катализатор. Катализаторы - это вещества, которые ускоряют химические реакции, не изменяя при этом своей структуры и не участвуя непосредственно в реакции. Они могут снижать энергию активации реакции, создавать благоприятные условия для встречи реагентов, образовывать промежуточные комплексы и многое другое.
Катализаторы имеют огромное значение в промышленности, поскольку позволяют эффективно производить большие объемы продукции, снижая затраты времени и энергии. Они также позволяют добиться высокой степени превращения реагентов, что особенно важно в случае реакции, где образуется равновесие.
Воздействие катализатора на химическое равновесие основано на изменении скорости прямой и обратной реакций. Катализаторы могут увеличивать скорость одной из реакций, уменьшая скорость противоположной реакции. Таким образом, возможно сместить равновесие в сторону образования большего количества продукта.
Эффективность катализатора определяется его активностью и стабильностью. Активность катализатора связана с его способностью ускорять реакцию, а стабильность обеспечивает сохранение своих свойств на протяжении длительного времени. Хорошо разработанный катализатор должен быть селективным, то есть способным катализировать только целевую реакцию, предотвращая побочные реакции.
В итоге, катализаторы играют важную роль в изменении химического равновесия, позволяя управлять ходом реакций и повышать эффективность промышленных процессов.
Эффективность катализаторов
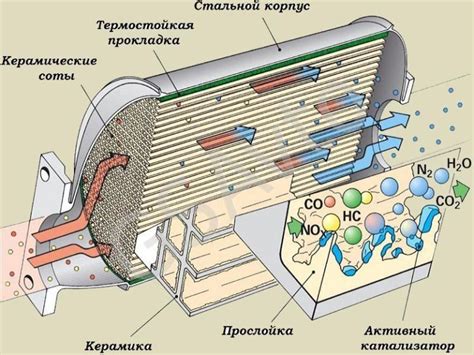
Одним из наиболее важных показателей эффективности катализатора является его активность. Активность катализатора определяется скоростью реакции при его применении. Чем выше активность катализатора, тем быстрее проходит реакция.
Однако, помимо активности, также важна стабильность катализатора. Идеальный катализатор должен сохранять свою активность в течение длительного времени и не разрушаться под влиянием условий реакции.
Разница в эффективности различных катализаторов может быть объяснена их химическим составом и структурой. Катализаторы, содержащие активные металлы или соединения, могут иметь высокую активность, так как эти элементы способны взаимодействовать с реагентами на поверхности катализатора.
Важным фактором эффективности катализатора является также его селективность. Селективность катализатора определяет, какие продукты реакции будут образовываться в результате его действия. Идеальный катализатор должен обладать высокой селективностью к желаемому продукту реакции.
В целом, эффективность катализаторов зависит от нескольких факторов, включая их активность, стабильность, химический состав и селективность. Использование эффективного катализатора может значительно ускорить реакцию и увеличить выход желаемого продукта, что делает катализаторы неотъемлемой частью многих промышленных и лабораторных процессов.
Кинетика реакций с катализаторами
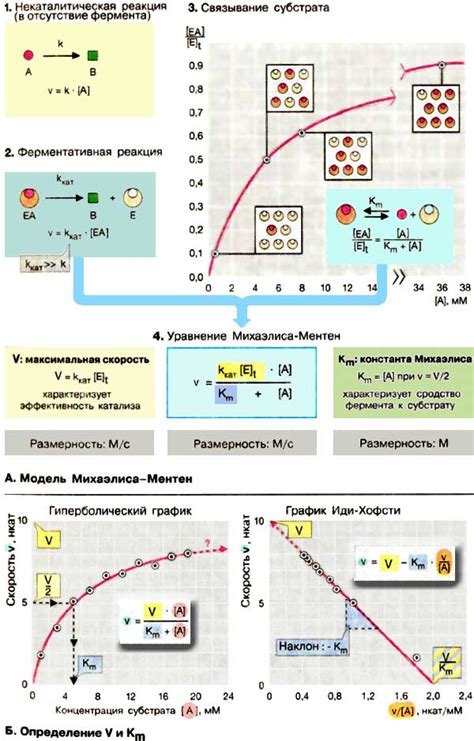
Кинетика реакций с катализаторами изучает скорость химических превращений при наличии катализатора. Катализаторы могут значительно ускорять химические реакции, снижая активационную энергию и снижая энергию активированного комплекса. Они действуют путем предоставления альтернативного реакционного пути с меньшей энергией активации или улучшают вероятность столкновения реагентов.
Кинетика реакции с катализатором определяется множеством факторов, таких как тип катализатора, концентрация реагентов, температура, давление и физические свойства реакционной среды. Изменение любого из этих факторов может влиять на скорость реакции и эффективность катализатора.
Существуют различные типы катализаторов, такие как гетерогенные и гомогенные катализаторы. Гетерогенные катализаторы находятся в разных фазах с реагентами и продуктами реакции, в то время как гомогенные катализаторы находятся в одной фазе с реагентами и продуктами.
Кинетика реакций с катализаторами может быть описана различными моделями, такими как модель Михаэлиса-Ментен, модель Лангмюра-Хиншеляв, модель Шота и другими. Эти модели позволяют описать зависимость скорости реакции от концентрации реагентов и катализатора.
| Тип катализатора | Примеры | Преимущества | Недостатки |
|---|---|---|---|
| Гетерогенный | Платина, никель, железо | Может быть легко отделен от продуктов реакции, может быть использован повторно | Не всегда эффективен для всех реакций, требует определенной структуры поверхности |
| Гомогенный | Хлорид рода, льюисовы кислоты и основания | Высокая активность, действует более специфично для определенных реакций | Требует определенных условий реакции, трудно отделить от продуктов реакции |
В целом, использование катализаторов может быть очень полезным в химических превращениях, так как они могут значительно ускорить реакции и обеспечить высокую конверсию реагентов. Однако, выбор катализатора и оптимальных условий реакции важен для достижения наилучших результатов.
Факторы, влияющие на эффективность катализатора

Катализаторы играют важную роль в изменении химического равновесия путем ускорения реакции. Эффективность катализатора может зависеть от различных факторов. Рассмотрим наиболее значимые из них:
- Активность катализатора: активность катализатора определяется его способностью участвовать в химической реакции и ускорять ее процесс. Высокая активность катализатора позволяет достичь желаемой реакции с меньшими затратами времени и энергии.
- Селективность катализатора: селективность катализатора означает его способность к ускорению конкретной реакции, исключая побочные реакции. Чем выше селективность катализатора, тем более эффективно он выполняет свою функцию.
- Стабильность катализатора: стабильность катализатора определяет его способность сохранять свои каталитические свойства на протяжении длительного периода времени без существенных изменений. Стабильные катализаторы обеспечивают более длительный период использования и сохраняют свою эффективность.
- Поверхностная площадь катализатора: поверхностная площадь катализатора является важным фактором, влияющим на его эффективность. Чем больше поверхностная площадь катализатора, тем больше активных центров и, следовательно, больше возможностей для химических взаимодействий.
- Размер и форма катализатора: размер и форма катализатора могут повлиять на его эффективность. Оптимальный размер частиц катализатора может обеспечить максимальную активность и поверхностную площадь, что приводит к улучшению эффективности реакции.
- Концентрация реактивов: концентрация реактивов также может влиять на эффективность катализатора. Высокая концентрация реактивов может способствовать более интенсивной реакции и улучшению эффективности катализатора.
Однако необходимо учитывать, что эффективность катализатора зависит от конкретной химической реакции и условий ее проведения. Катализаторы могут быть оптимизированы и модифицированы для достижения максимальной эффективности в конкретных условиях.
Применение катализаторов в промышленности и быту

В промышленности катализаторы применяются для ускорения различных процессов, таких как:
- Окисление водорода для получения воды и электроэнергии.
- Производство аммиака при синтезе азота и водорода.
- Производство пластмасс и полимеров.
- Получение бензина и других нефтепродуктов из сырой нефти.
- Очистка выбросов отредметов и выбросов автомобилей.
Помимо промышленности, катализаторы находят применение и в быту. Например:
- Катализаторы используются в катализаторах для очистки воды от загрязнений и расщепления вредных веществ, таких как хлор.
- Использование катализаторов в газовых плитах позволяет эффективно сжигать газ, минимизируя выбросы.
- В автомобилях катализаторы применяются для снижения содержания вредных выбросов.
Применение катализаторов в промышленности и быту позволяет снизить энергозатраты, улучшить качество продукции и сократить негативное воздействие на окружающую среду.