Мыло – один из наиболее распространенных бытовых предметов, использование которого мы не задумываемся. Оно нам всегда помогает очистить руки и тело, а также избавиться от грязи и жира. Но почему раствор мыла пенится в воде? Что происходит на молекулярном уровне, чтобы получить пену?
Основной активной составляющей мыла является жирная кислота. В процессе производства мыла, жирные кислоты реагируют с щелочью, образуя соли – мыльные молекулы. Такие мыльные молекулы состоят из двух частей: длинного углеродного хвоста и полярной головы.
Длинный углеродный хвост является гидрофобной частью мыла, что означает, что он не растворяется в воде и предпочитает взаимодействовать с другими гидрофобными молекулами, такими как жиры и масла.
С другой стороны, полярная голова является гидрофильной, что означает, что она растворяется в воде и предпочитает взаимодействовать с положительно или отрицательно заряженными молекулами, такими как молекулы воды.
Вода, как известно, является полярным растворителем. Когда мыло попадает в воду, гидрофобные хвосты мыльных молекул связываются между собой, образуя внутренний слой, а гидрофильные головы остаются снаружи, взаимодействуя с молекулами воды. Эти два слоя создают пузырьки пены – пены мыла.
Механизм работы пены

Раствор мыла, попав в воду, начинает образовывать пену благодаря своим особым свойствам.
Мыло состоит из молекул, которые имеют гидрофильную (любящую воду) и гидрофобную (не любящую воду) части. Когда мыло попадает в воду, его гидрофильные части притягиваются к молекулам воды, образуя по поверхности воды слой, называемый мицеллами.
Мицеллы формируются таким образом, чтобы гидрофобные части мыла были обращены друг к другу, а гидрофильные части – к воде. Из-за такого расположения частиц мыла, образуется структура, которая называется мицеллярной трубкой.
При механическом воздействии на мицеллы, например, при трении рук, мицеллярные трубки начинают разрушаться, освобождая газовые пузырьки, придающие пене свой характерный вид.
Таким образом, раствор мыла пенится в воде из-за образования мицеллярных структур, которые разрушаются под действием механического воздействия, образуя пузырьки пены.
Образование пузырьков
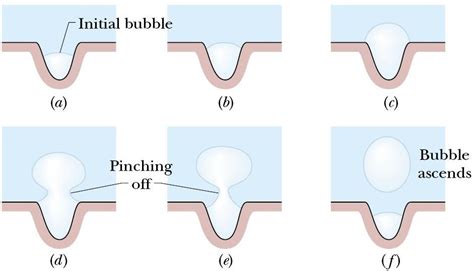
При контакте раствора мыла с водой происходит процесс образования пузырьков. Молекулы мыла находятся в двух состояниях: положительно заряжеными и отрицательно заряжеными. Вода также имеет положительный и отрицательный заряд.
Когда раствор мыла попадает в воду, молекулы мыла ориентируются таким образом, что положительные заряды молекулы мыла смотрят на отрицательные заряды воды, и наоборот. Это явление называется ориентацией зарядов.
Соседние молекулы мыла соединяются друг с другом, образуя слои. При этом между слоями мыла оказывается тонкий слой воды. В свою очередь, молекулы мыла в слоях ориентируются таким образом, чтобы отрицательные заряды в молекулах мыла смотрели на положительные заряды молекул мыла в соседнем слое.
Когда на поверхности раствора мыла образуется множество слоев, образующиеся пузырьки сохраняются благодаря действию поверхностного натяжения. Это свойство позволяет пузырькам сохранять свою форму и не лопаться. Также поверхностное натяжение позволяет пузырькам существовать в течение некоторого времени, прежде чем они покинут раствор.
Когда пузырек увеличивается в размерах, из-за тонкого слоя воды между слоями мыла, молекулы мыла начинают двигаться в сторону самого тонкого слоя. Далее, молекулы мыла образуют двойную молекулярную оболочку вокруг пузырька, сохраняя его структуру.
Структура пены
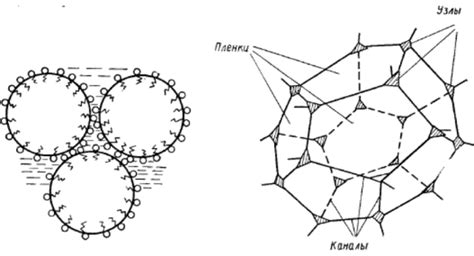
Основные компоненты структуры пены:
- Пузырьки воздуха - это газовые полости, окруженные жидкостной пленкой. Они являются основными элементами пены и отвечают за ее объем и объемность.
- Пленки - это тонкие жидкостные оболочки, которые окружают воздушные пузырьки и удерживают их в жидкости. Пленки состоят из молекул мыла или поверхностно-активных веществ, которые ориентируются поверхностными свойствами и создают межфазную границу.
- Дренажные каналы - это каналы, которые образуются между пузырьками воздуха и позволяют свободному движению жидкости между ними. Дренажные каналы управляют дренажем (сливом) жидкости из пузырьков и влияют на стабильность структуры пены.
Структура пены может быть разной в зависимости от состава мыла, его концентрации, температуры, типа воды и других факторов. Она может быть более или менее плотной, воздушной, стабильной или нестабильной.
Структура пены определяется балансом между силами поверхностного натяжения, гравитационными силами и дренажными силами. Сильные поверхностные натяжения и слабые гравитационные силы способствуют образованию более устойчивой пены, тогда как сильные гравитационные силы и слабое поверхностное натяжение могут привести к быстрому разрушению пены.
Свойства мыла
При взаимодействии мыла с водой происходит процесс, известный как взаимодействие между гидрофильной и гидрофобной частями молекулы. Гидрофильная часть мыла притягивается к молекулам воды, в то время как гидрофобная часть стремится избегать контакта с водой.
Когда мыло попадает в воду, его молекулы организуются в так называемые мицеллы. Внешняя гидрофильная часть молекул мыла обращена к воде, а гидрофобная часть находится внутри мицеллы. Эта организация молекул позволяет мылу пениться при взаимодействии с водой.
При взбивании мыла с водой, мицеллы распадаются на более мелкие частицы, которые называются микроэмульсиями. Микроэмульсии имеют гидрофобный слой, который окружает гидрофильные частицы мыла и заключает их внутри себя.
При движении воздуха, например при трении рук, эти микроэмульсии формируют пузыри. Свет и воздушные пузыри отражаются от поверхности мыла, создавая эффект пены.
Таким образом, раствор мыла пенится в воде из-за взаимодействия его молекул с молекулами воды и образования микроэмульсий, которые при движении образуют пены и пузыри.
Поверхностное натяжение
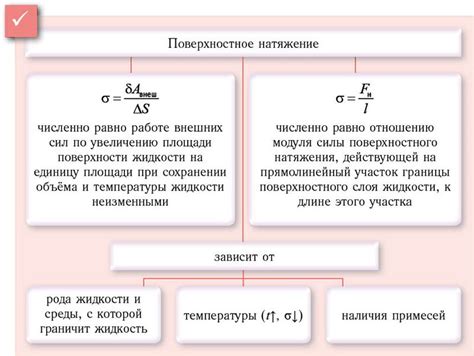
Поверхностное натяжение является одной из причин, по которой раствор мыла пенится в воде. При контакте с водой, молекулы мыла ориентируются таким образом, чтобы гидрофобные (неувлекающие воду) хвосты оказались внутри пузырька, а гидрофильные (увлекающие воду) головки - на поверхности. Это вызывает увеличение поверхностного натяжения внутри пузырька, что приводит к его пенеобразованию.
В таблице ниже представлены некоторые жидкости и их значением поверхностного натяжения:
| Жидкость | Поверхностное натяжение, Н/м |
|---|---|
| Вода | 0.0728 |
| Этиловый спирт | 0.0224 |
| Масло | 0.03-0.07 |
| Мыло | 0.03-0.07 |
Эмульгирование

Мыло содержит молекулы, называемые поверхностно-активными веществами. Эти молекулы имеют уникальную структуру, которая состоит из гидрофильной (любящей воду) и гидрофобной (не любящей воду) частей.
Когда мыло добавляется в воду, поверхностно-активные вещества организуются таким образом, что их гидрофильные концы обращаются к воде, а гидрофобные концы отталкивают ее. Это приводит к образованию мицелл - микроскопических структур, в которых гидрофобные хвосты объединяются внутри, а гидрофильные головки обращены наружу.
Когда взбалтывается раствор мыла, мицеллы перемещаются и ротируют, что дает пузырьки, известные как пена. Гидрофильные головки мицелл привлекают молекулы воды, в то время как гидрофобные хвосты связываются с молекулами загрязнений и жиров, образуя эмульсию. Мицеллы также уменьшают поверхностное натяжение воды, что помогает пузырькам пены сохранять свою форму и стабильность.
Так как мыло не смешивается с водой изначально, эмульгирование позволяет эффективно очищать и удалять загрязнения с поверхности кожи или других материалов. Кроме того, эмульсия пены делает процесс использования мыла более удобным, так как пена легче наносится и распределяется по поверхности.
Реакция мыла с водой

Мыло представляет из себя смесь различных химических веществ, но главным его компонентом являются мыльные молекулы. Эти молекулы имеют особенную структуру, включающую в себя гидрофильную (любящую воду) и гидрофобную (не любящую воду) части. Именно благодаря этой структуре мыло становится эффективным очистителем.
Когда мыло попадает в контакт с водой, гидрофобные хвостики молекул мыла ориентируются в сторону воздуха, в то время как гидрофильные головки молекул оказываются окруженными молекулами воды. Эта ориентация молекул мыла ведет к образованию пузырьков, которые мы называем пеной. Из-за гидрофобных хвостов, пузырьки сохраняют свою структуру и не слипаются, образуя устойчивую пену.
Кроме того, мыльные молекулы также способны снижать поверхностное натяжение воды. Это значит, что они уменьшают силу притяжения между молекулами воды, что позволяет пузырькам пениться и разделяться на мельчайшие частицы. Именно благодаря этому свойству мыло обеспечивает эффективную очистку при использовании воды.
Таким образом, раствор мыла пенится в воде благодаря специальной структуре его молекул, которая позволяет образовывать устойчивую пену и снижает поверхностное натяжение воды.
Химический состав мыла

Основные химические компоненты мыла включают различные жирные кислоты, такие как стеариновая кислота, олеиновая кислота и лауриновая кислота. В зависимости от источника и процесса получения, состав мыла может варьироваться, что влияет на его свойства.
Для получения мыла применяется щелочное гидролизное растительное масло или жир. При этом щелочь (обычно натриевый гидроксид или калиевый гидроксид) реагирует с эстерами жирных кислот, образуя соли жирных кислот и глицерин. Результатом этой реакции является образование молекулярных сетей, которые обладают поверхностно-активными свойствами и способностью разбивать поверхностные натяжения.
Молекулярная структура мыла включает в себя длинные углеводородные цепи жирных кислот, которые соединены с головкой соли. Эта структура позволяет мылу легко соединяться с водой и создавать пенообразующие свойства. При попадании мыла в воду гидронийные иидроксильные ионы проявляют свойства неравновесных микроэлектродов , реагируют с минеральными солями, проявляют электролитные свойства.
Реакция с водой
Процесс образования пены при растворении мыла в воде основан на реакции между мылом и водой. Мыло представляет собой соль жирных кислот, которые имеют гидрофобный хвост и гидрофильную головку. Гидрофобные хвосты отталкивают воду, что и обеспечивает грязеотталкивающие свойства мыла.
При контакте мыла с водой происходит две основные реакции. Во-первых, гидрофобные хвосты мыла оказываются внутри капли, стремясь уйти от воды. В результате этого процесса мыльные молекулы образуют шаровидные мицеллы, внутри которых гидрофобные части находятся внутри, а гидрофильные группы обращены наружу.
Во-вторых, гидрофильные группы мыла образуют водородные связи с молекулами воды. Это позволяет мыльным мицеллам быть растворимыми в воде и обеспечивает пенение.
Когда мылом третьяется вода, мицеллы перемешиваются и образуют стабильную пену. При этом поверхностное натяжение воды снижается, что позволяет мылу легко распределиться и проникать в малейшие поры и трещины для эффективной очистки.
| Процесс | Результат |
|---|---|
| Растворение мыла в воде | Образование мыльных мицелл и пенения |
| Взаимодействие мыла с грязью | Эффективная очистка и удаление грязи |
Таким образом, реакция мыла с водой играет ключевую роль в его способности образовывать пену и эффективно удалять грязь. Это объясняет, почему мыло пенится в воде и является важным компонентом в процессе очистки.