В мире химии основные оксиды играют важную роль, их состав и свойства изучаются в школьных учебниках и на университетских курсах. Они представляют собой соединения кислорода с металлами, обладающими высокой электроотрицательностью, такими как натрий, калий, кальций и другие.
Определение основного оксида может быть полезным для понимания его физических и химических свойств. Для этого требуется провести несколько простых шагов, которые мы рассмотрим в этой инструкции. Для начала соберите все необходимые инструменты: пробирку, химическое вещество, пипетку, лабораторную палочку и фенольфталеин.
Вторым шагом будет подготовка пробирки для эксперимента. Очистите пробирку от возможных загрязнений и остатков предыдущих экспериментов. Затем с помощью пипетки внесите небольшое количество химического вещества в пробирку. Важно помнить, что конкретное химическое вещество будет зависеть от того, какой основный оксид вы хотите определить.
Теперь перейдем к самому эксперименту. Вставьте лабораторную палочку в пробирку с химическим веществом и аккуратно перемешайте его. При этом обратите внимание на появление любых химических реакций или изменений цвета вещества. Если при перемешивании происходит выделение газа или изменение цвета, вы можете сделать предположение о наличии определенного основного оксида.
Наконец, чтобы окончательно узнать, какой именно основный оксид присутствует, вы можете использовать фенольфталеин. Просто добавьте несколько капель фенольфталеина в пробирку с химическим веществом и еще раз перемешайте. Если раствор станет красным или розовым, это означает наличие основного оксида.
Основной оксид – что это?
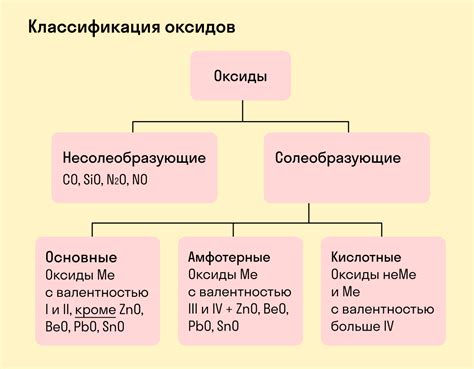
Основные оксиды часто образуются в результате реакции металлического металла с кислородом или водой. Их основная характеристика – это способность реагировать с кислотами. После реакции образуется соль и вода.
Примеры основных оксидов включают оксид натрия (Na2O), оксид кальция (CaO), оксид магния (MgO) и оксид алюминия (Al2O3). Они широко применяются в различных отраслях промышленности, в том числе в производстве стекла, цемента и керамики.
Определение основного оксида может быть полезно при изучении химии и в промышленных процессах, связанных с производством и использованием металлов. Правильное определение основного оксида позволяет более точно понять его свойства и возможные реакции с другими веществами.
Определение основного оксида

Основные оксиды легко определить по следующим признакам:
- Обычно основные оксиды образуют ионы гидроксидов, которые проявляют щелочные свойства.
- В реакциях оксидов с водой образуютcя щелочные растворы. Так, например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH) - сильное щелочное вещество.
- Основные оксиды реагируют с кислотами, образуя соли и воду. Например, оксид кальция (CaO) реагирует с серной кислотой (H2SO4), образуя соль (CaSO4) и воду (H2O).
Примечание: Важно помнить, что не все оксиды являются основными. Чтобы точно определить, является ли вещество основным оксидом, необходимо изучить его химические свойства и провести ряд химических реакций.
Физические свойства основного оксида

Однако, есть несколько общих характеристик основных оксидов. Во-первых, они обычно представляют собой кристаллические соединения с высокой плотностью.
Основные оксиды часто обладают металлическими свойствами, такими как хорошая теплопроводность и электропроводность. Они также могут быть твердыми веществами при комнатной температуре и давлении.
Оксиды металлов могут обладать различными цветами - от белого до черного. Некоторые основные оксиды также имеют способность изменять цвет в зависимости от окружающей среды или температуры.
Физические свойства основного оксида могут быть изменены при воздействии других веществ или при изменении условий окружающей среды. Например, основные оксиды могут реагировать с водой, кислотами или другими химическими соединениями, изменяя свою структуру и свойства.
Химические свойства основного оксида

Основной оксид представляет собой вещество, обладающее щелочными свойствами и способное образовывать гидроксиды при реакции с водой.
Основной оксид обладает сильными основными свойствами и способен растворяться в воде с образованием щелочных растворов. При этом происходит диссоциация оксида, ионный фрагмент которого взаимодействует с молекулами воды, образуя гидроксид. Реакция происходит с выделением тепла, и поэтому такие реакции являются экзотермичными.
Основные оксиды широко используются в различных областях химии и промышленности. Они применяются в производстве щелочей, стекла, электролитических растворов и многих других веществ.
Как узнать основной оксид

- Изучите формулу химического вещества, для которого вы хотите определить основной оксид. Обычно основными оксидами являются оксиды металлов, например, оксид натрия (Na2O) или оксид калия (K2O).
- Посмотрите на валентность металла в формуле оксида. Иногда в формуле может быть указана валентность металла (например, Fe2O3).
- Подумайте о свойствах металла. Если металл находится в левой части периодической таблицы, то скорее всего это основной оксид. Например, натрий (Na) и калий (K) являются щелочными металлами, поэтому их оксиды также будут основными.
- Учтите, что основные оксиды обычно образуют щелочные растворы при взаимодействии с водой. Если химическое вещество, для которого вы ищете основной оксид, образует щелочную реакцию с водой (например, растворяется с образованием щелочи и выделением тепла), то это, скорее всего, основной оксид.
Следуя этой инструкции, вы сможете определить основной оксид для большинства химических веществ. Помните, что основные оксиды играют важную роль в химических реакциях и имеют множество применений в промышленности и научных исследованиях.
Примеры основных оксидов
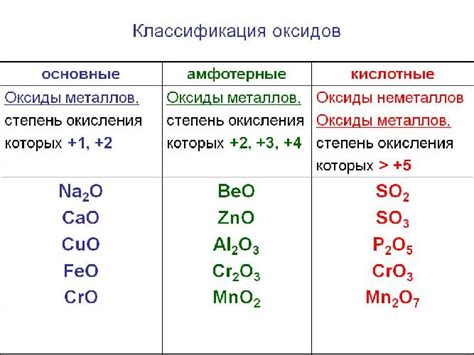
Оксид натрия (Na2O): является основным оксидом натрия. Он образуется при соединении натрия с кислородом. Оксид натрия широко используется в производстве стекла и мыла.
Оксид железа (Fe2O3): представляет собой основной оксид железа. Он образуется при соединении железа с кислородом. Оксид железа применяется в качестве пигмента в красках и косметике.
Оксид алюминия (Al2O3): является основным оксидом алюминия. Он образуется при соединении алюминия с кислородом. Оксид алюминия используется в производстве керамики, а также в качестве катализатора.
Изучение основных оксидов помогает нам понять основные химические свойства металлов и их взаимодействия с кислородом.