Химическое равновесие – это ключевой аспект в изучении химии. При достижении равновесия реакция происходит в обоих направлениях с одинаковой скоростью, что приводит к постоянному состоянию системы. Но как достичь этого равновесия и удержать его на протяжении времени? В этой статье мы расскажем об эффективных стратегиях и полезных советах, которые помогут вам достигнуть стабильности в химических реакциях.
Первое, что необходимо учитывать, – правильный выбор реагентов и оптимальные условия реакции. Некоторые реагенты могут приводить к более стабильным результатам, чем другие. Также следует учитывать температуру, давление и концентрацию реагентов, которые могут оказывать существенное влияние на скорость и направление реакции. Контроль этих параметров поможет достичь равновесия.
Второй важный аспект – использование катализаторов. Катализаторы способны ускорить химическую реакцию, не изменяя при этом итогового равновесия. Они увеличивают скорость обратной реакции, что способствует моментальной компенсации любых изменений в системе и поддерживает равновесие. Выбор подходящего катализатора может существенно повысить стабильность реакции.
Наконец, третья стратегия – осуществление контроля и регуляции реакционной смеси. При постоянном мониторинге состава системы и мгновенном внесении корректировок возможно удержание равновесия. Контроль концентрации реагентов и продуктов, удаление накопившихся продуктов или добавление дополнительных реагентов – все это позволит управлять процессом и достичь желаемого равновесного состояния.
Кратко говоря, достижение равновесия в химии требует грамотного подхода и регулярного мониторинга процесса. Правильный выбор реагентов, использование катализаторов и контроль параметров реакции – все это поможет достичь стабильности и долговременного равновесия.
Стратегии достижения равновесия в химии
Вот несколько стратегий, которые могут быть использованы для достижения равновесия в химии:
1. Изменение концентрации реагентов и продуктов:
Путем изменения концентрации реагентов и продуктов, можно влиять на скорость реакций и достичь равновесия. Увеличение концентрации реагентов может способствовать прямой реакции, в то время как увеличение концентрации продуктов может способствовать обратной реакции.
2. Правильный выбор катализаторов:
Катализаторы - это вещества, которые ускоряют химические реакции и могут помочь достичь равновесия. Правильный выбор катализатора может повысить скорость реакции и уравновесить прямую и обратную реакции.
3. Регулирование температуры:
Изменение температуры может сказаться на скорости прямой и обратной реакций. Увеличение температуры обычно способствует прямой реакции, в то время как снижение температуры может способствовать обратной реакции.
4. Изменение давления:
Изменение давления может повлиять на скорость прямой и обратной реакций. Увеличение давления может способствовать реакции, в которых количество газообразных веществ уменьшается, в то время как снижение давления может способствовать реакциям, в которых количество газообразных веществ увеличивается.
5. Использование принципа Ле-Шателье:
Принцип Ле-Шателье - это правило, которое гласит, что система в равновесии будет реагировать на любые изменения внешних условий, чтобы снова достичь равновесия. Использование этого принципа может помочь предсказать, какие изменения внешних условий будут необходимы для достижения равновесия.
Эти стратегии могут быть использованы отдельно или в комбинации, чтобы достичь равновесия в химических реакциях. Важно помнить, что каждая реакция уникальна, и может потребоваться экспериментировать с различными стратегиями для достижения желаемых результатов.
Эффективность процесса равновесия
Для достижения равновесия в химической реакции и поддержания его эффективности необходимо применять определенные стратегии и соблюдать определенные принципы. В этом разделе мы рассмотрим несколько полезных советов, которые помогут вам повысить эффективность процесса равновесия.
1. Изменение концентрации реагентов Изменение концентрации реагентов может оказать прямое влияние на положение равновесия. Увеличение концентрации реагентов обычно способствует смещению равновесия в направлении образования продуктов, в то время как уменьшение концентрации реагентов способствует обратной реакции. Это связано с принципом Ле Шателье, который гласит, что система при нарушении равновесия смещается в направлении, которое компенсирует это нарушение. | 2. Изменение давления и объема Если реакция включает газы, изменение давления и объема системы может изменить положение равновесия. Увеличение давления обычно способствует переходу к направлению реакции с меньшим количеством молекул газа, тогда как увеличение объема системы обычно способствует реакции с большим количеством молекул газа. |
3. Изменение температуры Температура также может повлиять на положение равновесия. Повышение температуры обычно способствует реакции, которая поглощает тепло, тогда как снижение температуры способствует реакции, которая выделяет тепло. Важно понимать, что изменение температуры может изменить как скорость реакции, так и состав равновесия. | 4. Использование катализаторов Катализаторы - это вещества, которые ускоряют химическую реакцию, но не участвуют в ней. Использование катализаторов может быть эффективным способом повысить процесс равновесия, так как они снижают активационную энергию реакции, ускоряя обе прямую и обратную реакции. |
Применение этих стратегий и понимание их влияния на положение равновесия поможет вам достичь нужного состава продуктов и повысить эффективность химической реакции.
Влияние концентрации веществ на равновесие

В химических реакциях концентрация веществ играет важную роль в определении равновесия. Изменение концентрации одного или нескольких компонентов реакции может привести к сдвигу равновесия в определенном направлении.
Если концентрация реагентов увеличивается, то согласно принципу Ле Шателье равновесие будет смещаться в направлении образования большего количества продуктов. В случае увеличения концентрации продуктов, равновесие будет смещаться в направлении образования большего количества реагентов.
Кроме того, изменение концентрации одного компонента может оказывать каскадное воздействие на остальные компоненты реакции. Например, если увеличивается концентрация реагента, его реакция с продуктами может привести к образованию дополнительного количества продуктов или обратной реакции.
Важно учитывать, что влияние концентрации на равновесие может быть компенсировано другими факторами, такими как температура или давление. В результате, система может достичь нового состояния равновесия, которое учитывает изменения концентрации и другие факторы.
Температурные стратегии при достижении равновесия
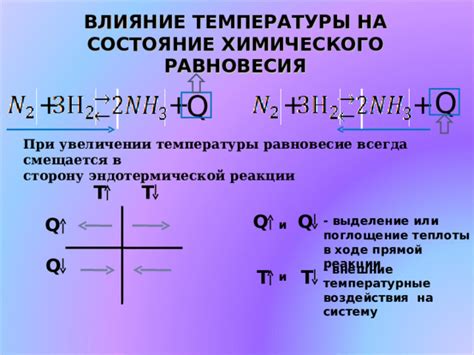
1. Влияние температуры на равновесие:
Известно, что увеличение температуры обычно сопровождается увеличением скорости химической реакции. При повышении температуры многие реакции становятся более быстрыми и получают больший выход продуктов. Однако у каждой реакции есть своя оптимальная температура для достижения максимального выхода продуктов. Необходимо учитывать этот фактор при выборе температурной стратегии.
2. Важность измерения температуры:
Для контроля и управления температурой в процессе химической реакции необходимо использовать надежные термометры. Точное измерение температуры позволяет правильно настраивать оборудование и следить за изменениями в процессе реакции.
3. Изменение температуры при нарушении равновесия:
В случае нарушения равновесия можно применять изменение температуры для восстановления желаемого равновесного состояния. Например, если реакция смещается влево, то повышение температуры может способствовать смещению равновесия вправо и увеличению выхода продуктов.
4. Длительность воздействия температуры:
При изменении температуры необходимо учитывать, что равновесие может восстановиться не сразу, а через некоторое время. Поэтому важно продолжать контролировать процесс и корректировать температуру, если это необходимо.
Важно помнить, что каждая химическая реакция уникальна и требует индивидуального подхода при выборе температурных стратегий. Следуя вышеприведенным советам, вы сможете более эффективно достичь равновесия в химии и улучшить результаты своих экспериментов.
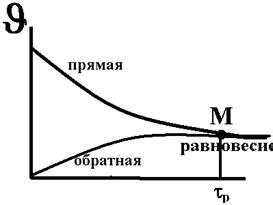
Оптимальная длительность реакции

В химических реакциях, достижение равновесия может занять разное количество времени в зависимости от условий, таких как концентрации реагентов и температура. Оптимальная длительность реакции определяется как время, необходимое для достижения стабильного равновесного состояния.
Однако, определение оптимальной длительности реакции не всегда просто. Во-первых, необходимо учитывать кинетические параметры реакции, такие как скорость протекания реакции и степень превращения реагентов. Во-вторых, реакции могут быть разного типа и требовать различных временных интервалов для достижения равновесия.
Чтобы определить оптимальную длительность реакции, полезно провести серию экспериментов с разными временными интервалами и анализировать полученные данные. Важно отметить, что оптимальная длительность реакции не всегда является самой короткой: в некоторых случаях длительная реакция может привести к более высокой конверсии реагентов и лучшему выходу продуктов.