Периодическая система химических элементов - это организационная таблица, которая наглядно отображает все известные химические элементы и позволяет увидеть связи между ними. Безусловно, это одна из самых важных и удивительных научных систем в истории науки. Она является ключом к пониманию строения и свойств всего материального мира, и позволяет нам предсказывать и создавать новые вещества.
Периодическая система состоит из горизонтальных строк, называемых периодами, и вертикальных столбцов, называемых группами. В каждой ячейке таблицы находится один химический элемент с определенным атомным номером, символом и атомной массой. Расположение элементов в периодической системе основано на их атомной структуре и свойствах.
В периодической системе элементы упорядочены по возрастанию атомного номера. Атомный номер определяет количество протонов в ядре атома и также равен количеству электронов в нейтральном атоме. Учитывая, что химические свойства проявляются именно взаимодействии электронов, расположение элементов по атомному номеру является логичным и удобным способом группировки элементов.
Структура периодической системы элементов и ее значение
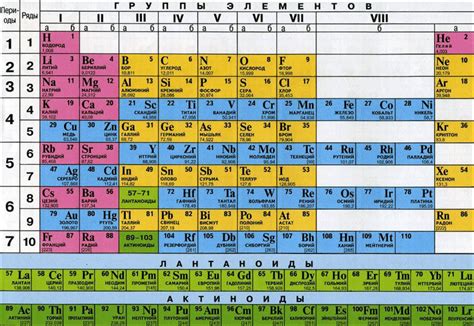
Периодическая система элементов (ПСЭ) представляет собой систематическое упорядочение химических элементов, отражающее их свойства и закономерности. Она состоит из горизонтальных строк, называемых периодами, и вертикальных столбцов, называемых группами, а также из блоков, подгрупп и серий элементов.
Структура ПСЭ имеет свою логику. Горизонтальные периоды представляют собой энергетические уровни атомов элементов: первый период - K-оболочка, второй - L-оболочка, третий - M-оболочка и так далее. Вертикальные группы отражают количество валентных электронов в атомах элементов.
Основными блоками в ПСЭ являются s-, p-, d- и f-блоки. s- и p-блоки находятся в основной части таблицы и включают основные и местные элементы, которые играют важную роль в химических реакциях и образуют связи в соединениях. d-блок состоит из переходных металлов, которые обладают характерными свойствами и широко используются в промышленности и технологиях. f-блок содержит элементы из блока атомов, которые отличаются особыми свойствами и применяются в различных областях науки и техники.
ПСЭ является универсальной системой классификации элементов и представляет собой основу для изучения и понимания химических закономерностей и свойств. Она позволяет определить расположение элемента и его свойства, а также найти общий язык для обмена информацией среди химиков и других наук.
Структура ПСЭ и ее значение обусловлены не только систематическим расположением элементов, но и наличием в ПСЭ информации о массе и атомном номере каждого элемента, его электронной конфигурации и химических свойствах. Такая информация играет ключевую роль в химических расчетах, исследованиях и разработках новых материалов.
Что такое периодическая система элементов
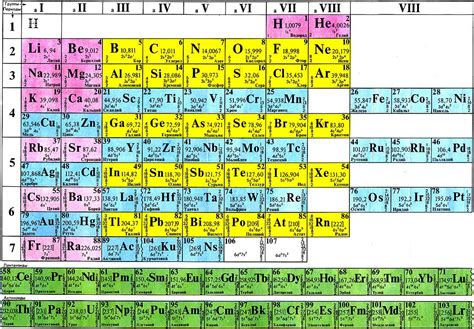
Периодическая система элементов была разработана русским химиком Дмитрием Менделеевым в конце XIX века. Она основана на особом принципе упорядочивания элементов, который называется периодичностью.
Периодическая система состоит из горизонтальных строк, называемых периодами, и вертикальных столбцов, называемых группами. Каждый элемент в системе имеет свой атомный номер, а также символ и название.
Расположение элементов во всей системе приводит к образованию групп, периодов и блоков. Группы объединяют элементы с общими химическими свойствами, а периоды указывают на последовательность заполнения электронных оболочек атомов.
Периодическая система использовалась и продолжает использоваться для изучения и понимания свойств и взаимодействий химических элементов. Она является важным инструментом в химии, физике и других науках, а также имеет широкое применение в промышленности.
Знание периодической системы элементов позволяет лучше понять и объяснить многочисленные явления и закономерности в мире химии и физики.
Периоды и группы в периодической системе
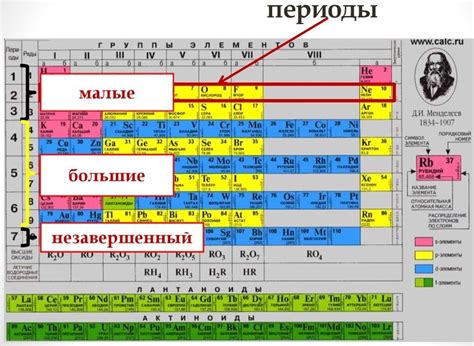
Периодическая система химических элементов состоит из таблицы, в которой элементы разделены на группы и периоды. Группы располагаются вертикально, а периоды горизонтально. Эта структура была разработана для систематизации и классификации элементов в соответствии с их свойствами и структурой атома.
Всего в периодической системе 7 периодов. Первый период содержит 2 элемента - водород и гелий. Второй период содержит 8 элементов - литий, мышьяк, бериллий, бор, углерод, нитроген, кислород и фтор. Третий и четвертый периоды также содержат 8 элементов каждый, включая металлы, такие как натрий, магний, алюминий и калий.
Группы в периодической системе обозначаются от 1 до 18 и содержат различное количество элементов. Общее число групп равно количеству электронов в внешней оболочке атома элемента. Например, первая группа, также известная как щелочные металлы, содержит элементы с одним электроном во внешней оболочке. Вторая группа, или щелочноземельные металлы, содержит элементы с двумя электронами во внешней оболочке.
Группы периодической системы также имеют общие химические свойства. Например, металлы находятся слева в периодической системе и образуют большинство групп. Неметаллы находятся справа от периодической системы, а полуметаллы называются металлоидами и располагаются по диагонали между металлами и неметаллами.
| Группа | Обозначение | Примеры элементов |
| 1 | Щелочные металлы | Литий, натрий, калий |
| 2 | Щелочноземельные металлы | Бериллий, магний, кальций |
| 3-12 | Переходные металлы | Железо, медь, цинк |
| 17 | Галогены | Фтор, хлор, бром |
| 18 | Благородные газы | Гелий, неон, аргон |
Расположение элементов в периодической системе позволяет установить связи между их свойствами и предсказать химические реакции. Химики используют периодическую систему для изучения и понимания поведения и взаимодействия различных элементов.
Элементы, расположенные в периодической системе
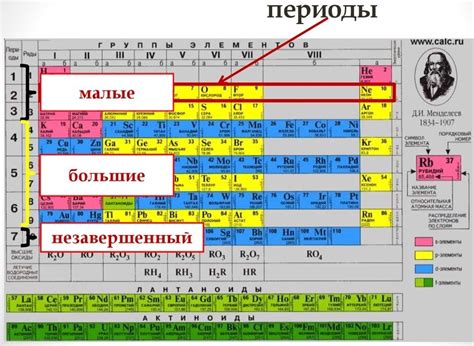
Периодическая система основана на уникальных свойствах элементов и их атомных номерах. Она помогает в классификации элементов и предсказывает их химическое поведение.
Элементы в периодической системе расположены в порядке возрастания атомных номеров. Каждый элемент имеет уникальный символ, например, H для водорода и O для кислорода.
Элементы разделены на группы и периоды. Группы это вертикальные столбцы, а периоды это горизонтальные строки. Каждая группа или период имеет свои особенности и химические свойства.
Некоторые группы имеют общие характеристики, например, группа щелочных металлов включает элементы с одним валентным электроном, что делает их очень реактивными и полезными для создания соединений.
Периодическая система также позволяет предсказывать свойства элементов, основываясь на их месте в таблице. Например, элементы в одной группе имеют аналогичные химические свойства. Это всеобъемлющее представление элементов помогает химикам в исследованиях и разработке новых соединений и материалов.
В периодической системе есть также редкие и трансурановые элементы, которые находятся в нижней части таблицы. Редкие элементы химически сходны с элементами основной таблицы, но их встречаемость гораздо ниже. Трансурановые элементы - это элементы с атомными номерами выше 92 (после урана), они получены искусственно и очень нестабильны.
Таким образом, периодическая система химических элементов предоставляет систематическое и удобное представление всех элементов. Это помогает в понимании и изучении химии, а также в разработке новых материалов и технологий.
Физические и химические свойства элементов

Физические свойства элементов определяются их физическим состоянием (твердое, жидкое или газообразное) при стандартных условиях температуры и давления. Они включают плотность, температуру плавления и кипения, электрическую проводимость и магнитные свойства.
Химические свойства элементов, в свою очередь, определяют их способность образовывать соединения и реагировать с другими веществами. Они описывают степень реакционной способности элемента, его окислительно-восстановительные свойства, кислотно-основные свойства и групповое принадлежность.
Периодическая система помогает сопоставлять и сравнивать физические и химические свойства различных элементов, что позволяет лучше понять их поведение и применение в различных областях науки и технологий.
Стехиометрические закономерности в периодической системе

Стехиометрия - раздел химии, изучающий количественные соотношения между реагентами и продуктами химических реакций. И в периодической системе мы можем найти много интересных закономерностей, связанных с этим аспектом.
Одна из наиболее известных стехиометрических закономерностей - закон массовых долей. Он утверждает, что массовые доли элементов в химических соединениях всегда имеют определенное числовое соотношение. Этот закон часто называют основополагающим для стехиометрии, потому что он позволяет предсказывать соотношение веществ в реакциях и указывает на возможные составы химических соединений.
Следующая интересная закономерность - закон кратных пропорций. Он утверждает, что элементы могут объединяться в различные химические соединения, и при этом отношение масс одного элемента к массе другого может быть представлено простыми числами. Этот закон выступает важным доказательством атомной теории и позволяет определять формулы химических соединений с высокой точностью.
Также в периодической системе можно найти закон пропорций взаимных действий. Он утверждает, что элементы в реакции могут соединяться в различных пропорциях, но только одна из них приводит к образованию стабильного соединения. Этот закон показывает, как важно соблюдать правильное соотношение элементов при проведении химических реакций.
Стехиометрические закономерности в периодической системе отражают фундаментальные принципы химии и помогают углубить наше понимание взаимосвязи между элементами и их соединениями. Изучение этих закономерностей помогает нам предсказывать и объяснять химические реакции, а также создавать новые вещества с определенными свойствами.
Приложения периодической системы в науке и технологиях

В научных исследованиях периодическая система позволяет классифицировать элементы и строить связи между ними. Она помогает прогнозировать поведение новых элементов и предсказывать их свойства на основе свойств соседних элементов в таблице.
В технологиях периодическая система также имеет огромное значение. Она используется в различных отраслях, таких как материаловедение, химия, электроника и многих других. На основе свойств элементов, задокументированных в таблице, разрабатываются новые материалы с определенными характеристиками. Например, на основе изучения свойств элементов, создаются материалы, обладающие специальными свойствами, такими как высокая прочность или устойчивость к коррозии.
Технологии, основанные на периодической системе, трансформируют разные отрасли промышленности и науки. Медицинская диагностика и лечение становятся эффективнее благодаря разработке новых препаратов и методов, основанных на знаниях о химических свойствах элементов. Электроника и информационные технологии развиваются впечатляющими темпами, вдохновленные новыми материалами и разработкой более мощных устройств.
Возможности периодической системы в науке и технологиях практически неисчерпаемы. Благодаря этой системе мы можем углубить наши знания о мире элементов и использовать эту информацию для создания более эффективных и продвинутых технологий.
Как интерпретировать и использовать периодическую систему элементов
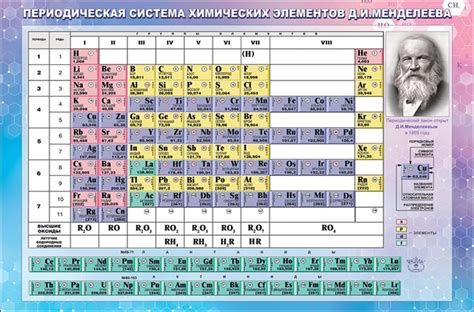
Периодическая система элементов представляет собой удобную и информативную таблицу, которая помогает упорядочить и классифицировать все известные химические элементы. В этой таблице элементы располагаются по возрастанию атомного номера и организуются в определенные группы и периоды. Каждый элемент имеет уникальные свойства и характеристики, которые можно использовать для интерпретации и понимания периодической системы.
Одной из основных характеристик элементов в периодической системе является их атомный номер. Атомный номер представляет собой количество протонов в атоме элемента и указывает на его положение в таблице. Чтение периодической системы начинается с верхнего левого угла и движется слева направо по периодам и сверху вниз по группам.
Группы в периодической системе представляют собой столбцы, которые объединяют элементы с схожими химическими свойствами. Например, элементы в одной группе могут иметь похожую электронную конфигурацию, что влияет на их реакционную способность и химическую активность. Группы обозначаются числами от 1 до 18, и каждая группа имеет свое уникальное имя или символ.
Периоды в периодической системе представляют собой строки, которые группируют элементы с похожим количеством энергетических уровней. Каждый период обозначается числом от 1 до 7. Более высокие периоды содержат элементы, у которых больше энергетических уровней, и они расположены ниже по таблице.
С помощью периодической системы элементов можно многое узнать о свойствах и характеристиках химических элементов. Например, она может помочь понять, какие элементы являются металлами, неметаллами или полуметаллами, какие элементы обладают похожими свойствами и могут быть использованы для различных химических реакций и процессов, а также дает возможность предсказывать химическую активность и свойства новых или малоизученных элементов.
Периодическая система элементов не просто информационная таблица, она является мощным инструментом для изучения и понимания химических процессов и свойств веществ. Правильное использование и интерпретация периодической системы помогает ученым и химикам в исследованиях и разработке новых материалов, лекарственных препаратов, технологий и многих других областях науки и промышленности.