Оксиды кислорода - это неотъемлемая часть многих химических соединений, которые находят применение в различных областях науки и промышленности. Они играют важную роль в процессах окисления, а также в реакциях с другими веществами. Определение формул оксидов кислорода имеет ключевое значение для понимания их свойств и применения.
Один из способов определить формулы оксидов кислорода - это анализ их состава и структуры. Как правило, оксиды кислорода состоят из атомов кислорода, связанных с атомами других элементов. Величина исследуемого оксида кислорода может предоставить информацию о количестве атомов кислорода и типа связей с другими элементами.
Например, окисление кислородом водорода образует воду - наиболее распространенный и простой оксид кислорода. Его формула H2O показывает, что в молекуле есть два атома водорода и один атом кислорода. Таким образом, зная формулу воды, можно сказать, что окислительным потенциалом кислорода является число 2.
Определение формулы оксида кислорода по названию элемента

Формулы оксидов кислорода могут быть определены по названиям элементов, из которых они состоят. Для этого необходимо учитывать заряд элемента и его положение в периодической таблице.
Оксиды кислорода могут содержать элемент кислород в различных сочетаниях с другими элементами. В названии оксида обычно указывается элемент, к которому приписывается оксиген.
Если название оксида начинается с приставки "окси-", то в формуле оксида кислорода присутствует элемент кислород с отрицательным зарядом. Например, оксид серы (Sulfur dioxide, SO2) - это соединение серы (S) с одной молекулой кислорода (O).
Если название оксида не содержит приставку "окси-", то в формуле оксида кислорода присутствует элемент кислород с положительным зарядом. Например, диоксид углерода (Carbon dioxide, CO2) - это соединение углерода (C) с двумя молекулами кислорода (O).
Таким образом, по названию элемента можно сделать предположение о формуле оксида кислорода, но для точного определения необходимо учитывать его заряд и положение в периодической таблице.
Методы определения валентности кислорода в оксиде
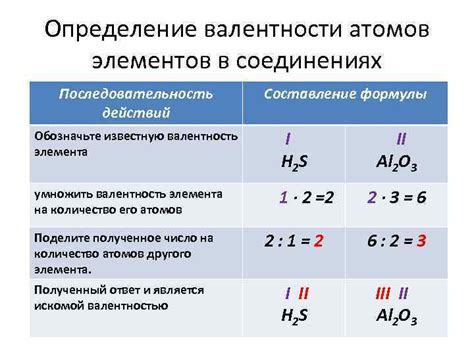
Метод окислительно-восстановительных реакций
Один из наиболее распространенных методов определения валентности кислорода в оксиде основан на окислительно-восстановительных реакциях. Суть метода заключается в том, что оксид, содержащий кислород, превращается в другой оксид или воду при взаимодействии с соответствующим веществом.
Метод магнетронного резонанса
Еще один метод определения валентности кислорода в оксиде – это метод магнетронного резонанса (МР). Он базируется на использовании особого типа спектрометра, который позволяет проследить изменение электронной структуры атомов кислорода в оксиде под воздействием электромагнитного поля.
Метод рентгеноструктурного анализа
Третий метод определения валентности кислорода в оксиде – это метод рентгеноструктурного анализа. С его помощью можно изучить кристаллическую структуру оксида, в том числе и атомов кислорода, и определить количество электронов в их валентных оболочках.
Описанные методы позволяют определить валентность кислорода в оксиде, что является важной информацией для понимания его химических свойств и взаимодействий с другими веществами.
Как определить степень окисления элемента в оксиде

При изучении оксидов кислорода важно уметь определять степень окисления элемента. Степень окисления указывает на изменение заряда атома при образовании оксида и помогает понять его реакционную способность. В этом разделе мы рассмотрим несколько методов определения степени окисления элемента в оксиде.
- Определение степени окисления через заряд оксида. В большинстве случаев, в оксидах кислорода он имеет заряд -2. Например, в оксиде углерода (СО2) и оксиде серы (SO2) кислород имеет степень окисления -2. Однако есть и исключения, например, в пероксидах кислорода (например, H2O2) и супероксидах (например, KO2) степень окисления кислорода может быть -1 или -1/2 соответственно. Поэтому при определении степени окисления через заряд оксида стоит быть внимательным к структуре и названию соединения.
- Определение степени окисления через заряд других элементов. Если известен заряд других элементов в оксиде, можно определить степень окисления кислорода путем вычитания зарядов других элементов из общего заряда оксида. Например, в оксиде меди (CuO) известно, что заряд меди составляет +2. Таким образом, заряд кислорода в оксиде меди будет -2 - (+2) = -4. Таким образом, степень окисления кислорода в оксиде меди составляет -4.
- Определение степени окисления через известные свойства вещества. В некоторых случаях степень окисления кислорода можно определить на основе известных свойств вещества. Например, в воде (H2O) кислород имеет степень окисления -2, так как степень окисления водорода в воде равна +1 (величина заряда водорода 1+), а сумма зарядов должна быть равна нулю. Таким образом, степень окисления кислорода в воде будет -2.
Знание степени окисления элемента в оксиде играет важную роль при проведении химических реакций и изучении свойств оксидов кислорода. С помощью описанных методов вы сможете легко определить степень окисления кислорода и углубить свое понимание химических процессов.
Типы оксидов в зависимости от степени окисления
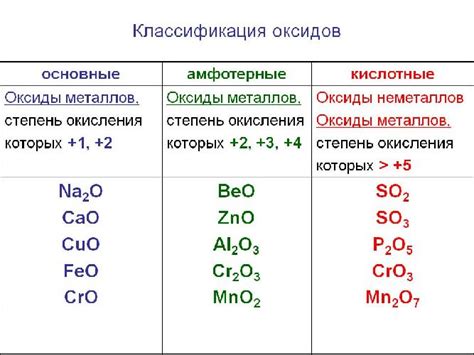
Оксиды кислорода могут быть классифицированы в зависимости от степени окисления, которая определяется числом кислородных атомов, связанных с другими элементами. Существует несколько типов оксидов в зависимости от степени окисления:
| Тип оксида | Описание |
|---|---|
| Пероксиды | Это оксиды, в которых кислород имеет степень окисления -1. Примером является перекись водорода (H2O2). |
| Супероксиды | Это оксиды, в которых кислород имеет степень окисления -1/2. Примером является супероксид иона (O2-). |
| Оксиды | Это оксиды, в которых кислород имеет степень окисления -2. Примеры включают оксиды металлов, такие как оксид алюминия (Al2O3) и оксид железа (Fe2O3). |
| Пероксокислоты | Это оксиды, в которых кислород имеет положительную степень окисления. Они образуются при реакции пероксидов с кислородом. Примером является пероксодисульфатная кислота (H2S2O8). |
Знание типов оксидов в зависимости от степени окисления поможет вам определять формулы оксидов кислорода и понимать их свойства и реактивность.
Как определить окислитель или восстановитель в реакции с участием оксидов кислорода
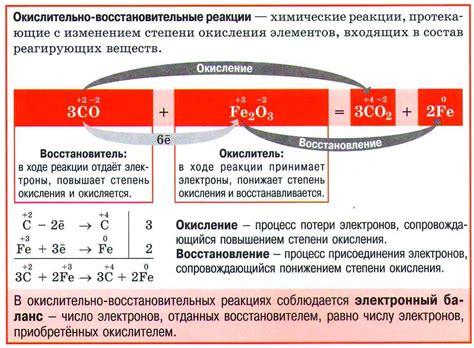
Степень окисления атома - это число, соответствующее электрическому заряду, который атом мог бы иметь, если бы электроны объекта перераспределялись полностью. При взаимодействии атомы могут получать или отдавать электроны, что приводит к изменению их степени окисления.
Если степень окисления атома увеличивается в результате реакции, то этот атом является вещественным компонентом, оказывающим воздействие на другие атомы (окислитель). Если степень окисления атома уменьшается, то этот атом - вещественный компонент, восстанавливающий другие атомы (восстановитель).
Один из способов определить окислитель и восстановитель в реакции с участием оксидов кислорода - использование таблицы степеней окисления. В этой таблице указаны примеры оксидов кислорода с соответствующими им степенями окисления.
Например, оксид кислорода с степенью окисления +2 будет восстановителем, а с более высокой положительной степенью окисления будет окислителем.
Еще один способ определить окислитель и восстановитель - анализируя изменение степени окисления атомов в реакции. Если степень окисления увеличивается, атом является окислителем. Если степень окисления уменьшается, атом является восстановителем.
Например, в реакции 2Cu + O2 → 2CuO степень окисления атомов меди изменяется с 0 до +2, что свидетельствует о том, что медь является окислителем, а кислород - восстановителем.
Таким образом, понимание того, как определить окислитель и восстановитель в реакции с участием оксидов кислорода, может помочь в анализе химических реакций и предсказании их продуктов.
Примеры формул оксидов кислорода с указанием валентности и степени окисления
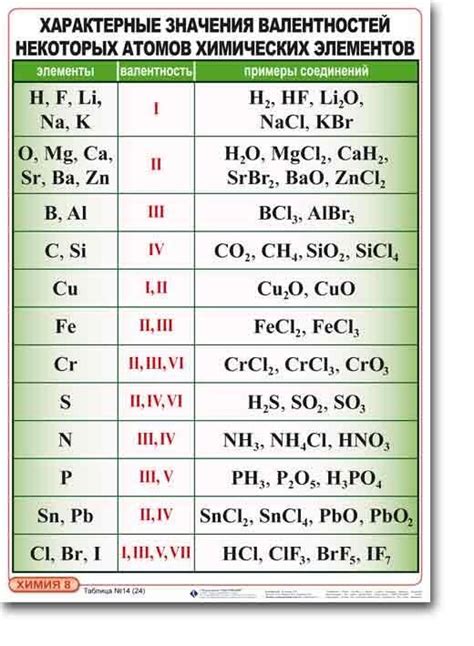
- Диоксид углерода (CO2) - карбоновый газ, состоящий из одного атома углерода и двух атомов кислорода. Валентность углерода равна +4, а степень окисления кислорода равна -2.
- Оксид азота(II) (NO) - безцветный газ с едким запахом. Валентность азота равна +2, а степень окисления кислорода равна -2.
- Оксид азота(IV) (NO2) - красно-коричневый газ с ядовитым запахом. Валентность азота равна +4, а степень окисления кислорода равна -2.
- Оксид серы(IV) (SO2) - безцветный газ с характерным запахом. Валентность серы равна +4, а степень окисления кислорода равна -2.
- Оксид серы(VI) (SO3) - белый кристаллический порошок. Валентность серы равна +6, а степень окисления кислорода равна -2.
- Оксид фосфора(V) (P2O5) - белый порошок со слабым запахом. Валентность фосфора равна +5, а степень окисления кислорода равна -2.
Это лишь некоторые примеры оксидов кислорода, их формулы и характеристики. Знание валентности и степени окисления в оксидах кислорода позволяет понять их химические свойства и использование в различных процессах. Будьте внимательны и аккуратны при работе с оксидами кислорода!
Важность и применение знания формул оксидов кислорода в химических реакциях и пространственной структуре молекул

Знание формул оксидов кислорода особенно полезно при изучении кислотно-основных реакций, где кислоты ищут потенциальных доноров протона, а основания - потенциальных акцепторов протона. Оксиды кислорода могут действовать как кислоты или основания в зависимости от своей формулы. Например, оксид кислорода с формулой NO2 может действовать как кислота, а оксид с формулой Na2O - как основание.
Также знание формул оксидов кислорода позволяет определить пространственную структуру молекул и их геометрию. Например, оксид кислорода с формулой CO2 имеет линейную геометрию, так как две кислородные атомы связаны с углеродным атомом без каких-либо других атомов. Однако, оксид с формулой H2O имеет гибридизованную геометрию, так как кислородный атом связан с двумя атомами водорода и имеет две свободные пары электронов.
В целом, знание формул оксидов кислорода играет важную роль в химических реакциях и изучении пространственной структуры молекул. Оно помогает установить свойства соединений, предсказать их реакционную активность и взаимодействие с другими веществами. Поэтому понимание формул оксидов кислорода является важным компонентом химического образования и исследования.