Решение задач по определению массы растворенного вещества в химии является одной из ключевых тем на уроках этого предмета в 8 классе. Этот навык не только поможет вам лучше понять мир химических реакций, но и пригодится в повседневной жизни. Ведь зная как найти массу растворенного вещества, вы сможете правильно рассчитать дозировку лекарства, приготовить нужное количество раствора или разведенной смеси, а также проводить различные химические эксперименты.
В этой статье мы рассмотрим несколько простых советов и примеров решения задач по определению массы растворенного вещества в химии для учеников 8 класса.
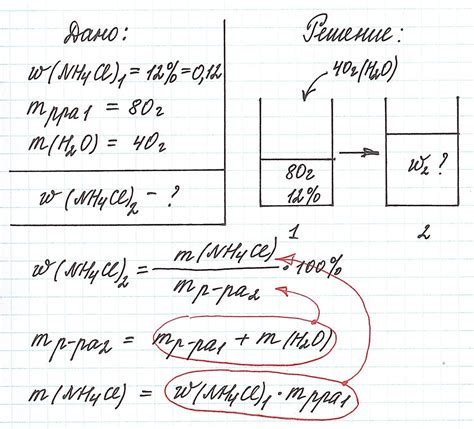
Прежде чем перейти к решению конкретных задач, необходимо разобраться с базовыми понятиями. Масса растворенного вещества - это количество данного вещества, размещенного в растворе. Определить массу растворенного вещества можно с помощью формулы М = m/V, где М - масса растворенного вещества, m - масса раствора, V - объем раствора.
Как найти массу растворенного вещества в химии 8 класс

В химии 8 класса изучается массовая доля растворенного вещества, которая выражается в процентах или граммах на 100 г раствора. Для того чтобы найти массу растворенного вещества, необходимо знать удельную массу данного вещества и процент его содержания в растворе. Ниже приведены основные способы решения задач данного типа.
- Если известна массовая доля растворенного вещества в процентах, можно воспользоваться следующей формулой: масса растворенного вещества = (масса раствора * массовая доля вещества) / 100. Например, если масса раствора составляет 200 г, а массовая доля вещества - 10%, то масса растворенного вещества будет равна (200 * 10) / 100 = 20 г.
- Если известна удельная масса растворенного вещества, то можно воспользоваться следующей формулой: масса растворенного вещества = масса раствора * массовая доля вещества. Например, если масса раствора составляет 100 г, а удельная масса вещества - 0,5 г/г, то масса растворенного вещества будет равна 100 * 0,5 = 50 г.
- Если известна масса раствора и объемная доля растворенного вещества, можно воспользоваться следующей формулой: масса растворенного вещества = масса раствора * плотность раствора * объемная доля вещества. Например, если масса раствора составляет 150 г, плотность раствора - 1 г/мл, а объемная доля вещества - 0,3 мл/100 мл, то масса растворенного вещества будет равна 150 * 1 * 0,3 = 45 г.
Важно помнить, что в реальности масса растворенного вещества может быть отличной от рассчитанной из-за факторов, таких как испарение растворителя или взаимодействие растворенного вещества с другими компонентами раствора. Однако, эти методы расчета позволяют получить приближенное значение массы растворенного вещества в химии 8 класса.
Советы для решения задач

Решение задач по нахождению массы растворенного вещества в химии 8 класс может быть достаточно простым, если вы будете следовать определенным шагам. Вот несколько полезных советов, которые помогут вам успешно решить такие задачи:
1. Внимательно прочитайте условие задачи и определите известные и неизвестные величины. Известные величины обычно указываются явно, а неизвестную величину нужно найти.
2. Используйте уравнения и законы химии, которые относятся к растворам и концентрации. Например, знание уравнения для расчета концентрации раствора или формулы для нахождения массы растворенного вещества может помочь вам в решении задачи.
3. Проверьте, имеете ли вы все необходимые данные для решения задачи. Если в условии задачи не указаны все необходимые данные, вернитесь к шагу 1 и еще раз внимательно прочитайте условие.
4. Проверьте правильность выполнения всех расчетов. Важно быть внимательным и аккуратным при решении задач, чтобы не допустить ошибок в расчетах или преобразованиях единиц.
5. Проверьте полученный ответ на соответствие логике и здравому смыслу. Если полученный ответ не согласуется с общепринятыми представлениями или звучит нелогично, возможно, вы допустили ошибку в расчетах.
6. Практикуйтесь в решении задач и выполняйте множество упражнений, чтобы стать более уверенным в решении задач по нахождению массы растворенного вещества. Чем больше вы упражняетесь, тем легче будет решать сложные задачи.
| Задача | Решение |
|---|---|
| Задача 1 | Решение задачи 1 |
| Задача 2 | Решение задачи 2 |
| Задача 3 | Решение задачи 3 |
Пример 1: Расчет массы растворенного вещества
Масса растворенного вещества = масса раствора * концентрация вещества
Например, представим ситуацию, когда в 500 граммах раствора содержится 50 граммов сахара. Чтобы найти массу растворенного сахара, нужно умножить массу раствора на концентрацию вещества:
| Масса раствора (г) | Концентрация вещества (г/г) | Масса растворенного сахара (г) |
|---|---|---|
| 500 | 0.1 | 50 |
Таким образом, в данном случае масса растворенного сахара составляет 50 граммов.
Это был пример простого расчета массы растворенного вещества. В химии можно столкнуться с задачами более сложного уровня, но основная идея остается той же.
Пример 2: Определение массовой доли вещества в растворе
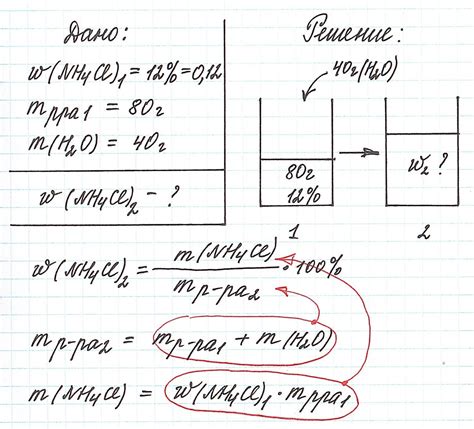
Давайте рассмотрим пример задачи, в которой нам необходимо определить массовую долю вещества в растворе. Это может быть полезно, например, при расчете концентрации раствора для химического эксперимента.
Предположим, у нас есть раствор, в котором содержится 40 г сахара и 160 г воды. Нам нужно найти массовую долю сахара в этом растворе.
Для решения этой задачи мы можем воспользоваться следующей формулой:
Массовая доля = (Масса вещества / Масса раствора) x 100%
В нашем случае, масса сахара равна 40 г, а масса раствора равна сумме массы сахара и массы воды, то есть 40 г + 160 г = 200 г.
Подставим эти значения в формулу:
| Масса вещества | Масса раствора | Массовая доля |
|---|---|---|
| 40 г | 200 г | (40 / 200) x 100% = 20% |
Таким образом, массовая доля сахара в растворе составляет 20%.
Надеюсь, что этот пример поможет вам лучше понять, как решать задачи по определению массовой доли вещества в растворе.