Одной из важных задач в химии является определение объема газа в реакции. Знание объема газа позволяет провести различные расчеты, определить степень реакции и объемные соотношения между реагентами и продуктами. В данной статье мы рассмотрим основные методы вычисления объема газа и формулу для его определения.
Для начала, вспомним, что газы имеют свойства расширяться и сжиматься в зависимости от давления, температуры и объема. Закон Бойля-Мариотта устанавливает, что при постоянной температуре количество газа обратно пропорционально его давлению. Иными словами, при увеличении давления, объем газа уменьшается, а при уменьшении давления – увеличивается.
Применяя формулу и заданные параметры, можно рассчитать объем газа в химических реакциях. Для этого необходимо знать стандартные условия (температура и давление), а также формулу применимого закона или уравнения. В химии наиболее часто применяются закон Бойля-Мариотта, закон Шарля и уравнение идеального газа.
Формула вычисления объема газа

В химии для вычисления объема газа используется универсальная газовая постоянная и уравнение состояния идеального газа. Формула для вычисления объема газа выглядит следующим образом:
V = (n * R * T) / P
где:
- V - объем газа
- n - количество вещества газа
- R - универсальная газовая постоянная (R = 8,314 дж/(моль·к)
- T - температура газа в кельвинах
- P - давление газа в паскалях
Данная формула позволяет вычислить объем газа при известных значениях количества вещества, температуры и давления. Универсальная газовая постоянная является постоянной величиной и используется для расчетов в различных условиях.
Вычисление объема газа с помощью этой формулы является важным шагом в химических расчетах и обеспечивает понимание количества вещества газа в определенных условиях.
Уравнение состояния идеального газа
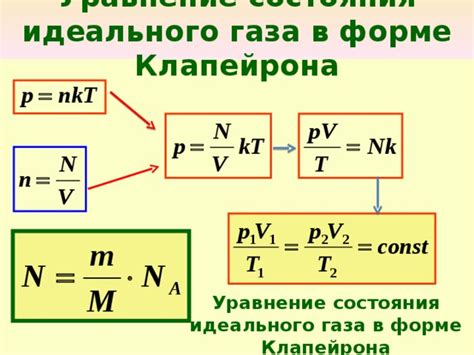
Уравнение состояния идеального газа можно записать следующим образом:
P × V = n × R × T
- P – давление газа (в паскалях или атмосферах)
- V – объем газа (в литрах или метрах кубических)
- n – количество вещества газа (в молях)
- R – универсальная газовая постоянная (значение: 8,314 Дж/(моль·К))
- T – температура газа (в кельвинах)
Данное уравнение основано на предположении об идеальности газа, то есть о том, что газ состоит из молекул, которые не взаимодействуют друг с другом и совершают молекулярные столкновения без потерь энергии.
Используя уравнение состояния идеального газа, мы можем решать различные задачи, связанные с определением объема газа при заданных значениях давления, температуры и количества вещества.
Влияние температуры на объем газа

Согласно закону Шарля, объем газа пропорционален его температуре при постоянном давлении. Формула закона Шарля выглядит следующим образом:
V₁/T₁ = V₂/T₂
где V₁ и V₂ - исходный и конечный объемы газа, а T₁ и T₂ - соответствующие начальная и конечная температуры.
К примеру, если начальный объем газа равен 2 литрам, а начальная температура равна 273 Кельвина (0 градусов Цельсия), а конечная температура 373 Кельвина (100 градусов Цельсия), то можно найти конечный объем газа, используя формулу закона Шарля:
V₂ = (V₁ * T₂) / T₁
Таким образом, при увеличении температуры с 273 Кельвина до 373 Кельвина, объем газа увеличится пропорционально.
Как найти объем газа при известном давлении

Для определения объема газа при известном давлении можно использовать закон Бойля-Мариотта. Согласно этому закону, при постоянной температуре количество газа обратно пропорционально давлению, то есть V ∝ 1/P.
Формула для расчета объема газа применяется следующим образом:
V = nRT/P,
где V - объем газа (в литрах), n - количество вещества газа (в молях), R - универсальная газовая постоянная (0,0821 л·атм/(моль·К)), P - давление (в атмосферах) и T - температура (в Кельвинах).
Чтобы найти объем газа при известном давлении, нужно знать количество вещества газа, универсальную газовую постоянную, давление и температуру. Подставьте значения в формулу и выполните необходимые вычисления.
Например, если количество вещества газа равно 2 моля, универсальная газовая постоянная равна 0,0821 л·атм/(моль·К), давление равно 3 атмосферы, а температура равна 300 Кельвинов, то расчет будет следующим:
V = 2 моль * 0,0821 л·атм/(моль·К) * 300 К / 3 атм = 2,46 литра.
Таким образом, объем газа при известном давлении равен 2,46 литра.
Методы вычисления объема газа в химических реакциях

- Метод передела процентного содержания газа: данный метод основывается на известном процентном содержании газа в смеси и позволяет вычислить его объем. Для этого необходимо знать массовую долю газа в смеси и молярную массу газа.
- Метод ПВТ: данный метод основывается на уравнении состояния идеального газа PV = nRT, где P - давление газа, V - его объем, n - количество вещества, R - универсальная газовая постоянная и T - температура газа. Путем преобразования этого уравнения можно рассчитать объем газа.
- Метод стандартных условий: данный метод основывается на применении стандартных условий температуры и давления, при которых объем газа можно выразить через его количество вещества. Знание молярного объема газа при стандартных условиях позволяет вычислить его объем.
Выбор метода вычисления объема газа зависит от имеющихся данных и целей расчета. Каждый из методов имеет свои особенности и применим в определенных ситуациях. Корректное использование методов вычисления объема газа позволяет провести точные расчеты и получить необходимые результаты в химических реакциях.
Советы по проведению экспериментов и вычислению объема газа

1. Правильное измерение объема газа: Используйте градуированный цилиндр или пикнометр для измерения объема газа с высокой точностью. Убедитесь, что масштабная лента цилиндра или пикнометра читается с точностью до миллилитров.
2. Учет факторов окружающей среды: Учитывайте давление и температуру окружающей среды при измерении объема газа. Эти факторы могут оказывать влияние на точность измерений. Для учета этих факторов используйте уравнение состояния газа, такое как уравнение идеального газа.
3. Правильная подготовка оборудования: Убедитесь, что все использованные приборы и оборудование чисты и не содержат следов прежних экспериментов или загрязнений. Это гарантирует точность и надежность ваших измерений.
4. Контрольные измерения: Для улучшения точности результатов проводите несколько контрольных измерений. Сравните полученные значения объема газа и усредните результаты, чтобы получить более точные и надежные данные.
5. Корректировка объема газа: Если измерения проведены при нестандартных условиях (не при стандартной температуре и давлении), используйте формулы и конвертеры для корректировки объема газа.
6. Запись результатов: Важно записывать все измерения и вычисления, чтобы иметь возможность провести дальнейший анализ и сравнение результатов. Записывайте значения объема газа в соответствии с единицами измерения (например, в литрах или кубических сантиметрах) и указывайте точность измерений.
7. Безопасность: При проведении экспериментов с газами обязательно соблюдайте все меры безопасности, указанные в инструкциях. Работайте в хорошо проветриваемой зоне и используйте защитные средства, если необходимо.
Следуя этим советам, вы сможете провести эксперименты с газами, получить точные результаты и правильно вычислить объем газа. Это поможет вам в более глубоком понимании химии и достижении успешных результатов в ваших исследованиях.