Оксиды являются одним из основных классов химических соединений и играют важную роль в мире науки и технологий. Они представляют собой соединения элементов с кислородом и имеют широкий спектр применений от производства металлов до каталитических реакций.
Для учащихся восьмого класса важно понимать, как идентифицировать оксиды и определять их формулы. Данные навыки помогут им не только в изучении химии, но и в понимании многих естественных процессов, происходящих вокруг нас.
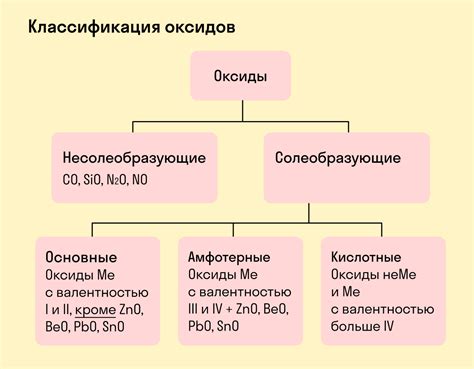
Ключевым элементом при поиске оксидов является идентификация кислорода, который всегда присутствует в оксидах. Чтобы определить, что соединение является оксидом, нужно проверить, есть ли кислород.
Например, водород оксид (H2O), который мы знаем как воду, состоит из двух атомов водорода и одного атома кислорода. Здесь мы видим, что кислород присутствует, поэтому это соединение является оксидом.
Оксиды: что это такое?
Оксиды могут быть образованы разными способами. Они могут образовываться при реакции кислорода с элементом или соединением, либо при окислении вещества. Оксиды также могут быть образованы при сгорании, окислении металлов или реакциях с кислотами.
Оксиды играют важную роль в различных областях. Некоторые оксиды используются в производстве стекла, керамики и электроники. Другие оксиды имеют значительное значение в природе, так как являются составной частью почв, минералов и горных пород.
Например, углекислый газ (CO2) – один из наиболее известных оксидов. Он образуется при сгорании органических веществ и играет важную роль в жизни растений, так как является питательным средством для фотосинтеза.
Таким образом, оксиды – это неотъемлемая часть химии, и их понимание имеет важное значение для дальнейшего изучения химических процессов и взаимодействий между веществами.
Как составить формулу оксида?
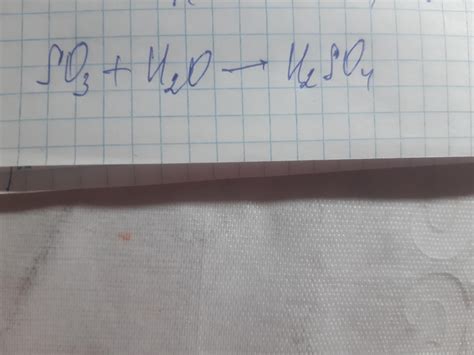
- Изучите типичные названия оксидов. Оксиды могут быть названы по первому элементу, за которым следует слово "оксид". Например, оксид натрия или оксид меди.
- Определите заряд кислорода в оксиде. Кислород обычно имеет заряд -2, но в некоторых случаях он может иметь другой заряд.
- Определите заряд другого элемента в оксиде. Заряд другого элемента можно найти в таблице химических элементов. У некоторых элементов заряд фиксирован (например, у алюминия +3), в то время как у других заряд может меняться (например, у железа +2 или +3).
- Определите количество атомов каждого элемента в формуле оксида. Количество атомов кислорода зависит от его заряда, а количество атомов другого элемента – от его заряда и требуемого заряда оксида.
Например, для составления формулы оксида натрия:
- Оксиды натрия принято называть "оксидом натрия".
- Заряд кислорода в оксиде равен -2.
- Заряд натрия равен +1.
- Для того чтобы сумма зарядов в оксиде составила 0, нужно 2 атома кислорода (2*(-2) = -4) и 1 атом натрия (+1).
Итак, формула оксида натрия будет Na2O.
Как найти оксид: упражнения и примеры
Пример 1:
Найдите оксид, в котором один атом кислорода соединен с двумя атомами водорода. Для этого необходимо знать, что химическая формула воды составляется из одного атома кислорода (O) и двух атомов водорода (H). Следовательно, это соединение можно назвать оксидом водорода, или водой (H2O).
Пример 2:
Найдите оксид, в котором один атом кислорода соединен с одним атомом натрия. Для этого необходимо знать, что химическая формула оксида натрия составляется из одного атома кислорода (O) и одного атома натрия (Na). Следовательно, это соединение называется оксидом натрия (Na2O).
Упражнение:
Найдите оксид, в котором один атом кислорода соединен с одним атомом кальция.
- Вариант A: КОCl
- Вариант B: CaO
- Вариант C: KCl
- Вариант D: SO2
Ответ: Вариант B - CaO. В этом соединении один атом кислорода (O) связан с одним атомом кальция (Ca), что означает, что это оксид кальция.
Оксиды в природе и промышленности: применение
1. Кремниевый диоксид (SiO2)
Кремниевый диоксид, также известный как кремнезем или кварц, является одним из главных компонентов песка. Этот оксид используется в производстве стекла, керамики, силикатных материалов и электронных компонентов. Кремниевый диоксид также применяется в косметике и стоматологии, например, для создания пасты для зубов и полировочных материалов.
2. Алюминиевый оксид (Al2O3)
Алюминиевый оксид, также известный как корунд или оксид алюминия, является одним из наиболее твердых и долговечных материалов. Из него производятся искусственные алмазы, бруски для заточки и шлифования, керамика, абразивные материалы и компоненты электроники. Кроме того, алюминиевый оксид используется в качестве наполнителя в косметических и фармацевтических продуктах.
3. Углеродный диоксид (CO2)
Углеродный диоксид играет ключевую роль в процессе фотосинтеза растений и является одним из главных газов в атмосфере Земли. В промышленности CO2 используется для охлаждения, сжижения и транспортировки. Также этот газ служит сырьем для производства растворов солей и соды, а также в сельском хозяйстве для улучшения роста растений в теплицах.
4. Железный оксид (Fe2O3)
Железный оксид, также известный как ржавчина или оксид железа, применяется в производстве красок, косметики, лаков, керамики и катализаторов. Он служит также основным составным элементом различных материалов, таких как бетон и кирпич.
5. Серный диоксид (SO2)
Серный диоксид является продуктом сгорания топлива и является одной из основных причин ухудшения качества воздуха в городах. Однако он также используется в промышленности для производства серной кислоты, отбеливания и консервации пищевых продуктов, а также в процессе обработки полимеров.
Это только некоторые примеры применения оксидов в природе и промышленности. Оксиды играют важную роль в различных областях нашей жизни и продолжают использоваться для создания разнообразных материалов и продуктов.
Оксиды: свойства и химические реакции
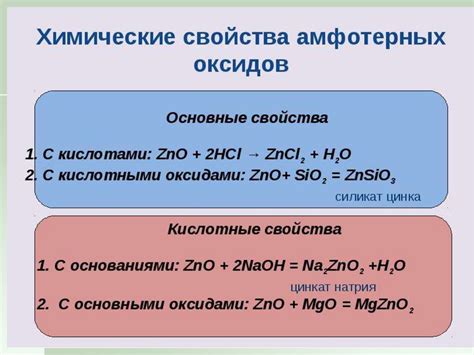
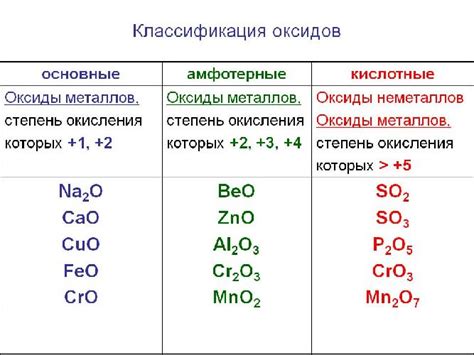
Свойства оксидов могут сильно варьироваться в зависимости от элементов, которые они содержат. Некоторые оксиды являются кислотными, другие - основными или нейтральными. Например, оксид кальция (CaO) является щелочным, а оксид серы (SO2) - кислотным.
Оксидности элементов могут быть положительными или отрицательными, в зависимости от количества окисляемого вещества в оксиде. Оксидность связана с числом электронов, которые элемент принимает или отдает при образовании своего оксида.
Оксиды обладают различной реакционной способностью. Некоторые оксиды могут взаимодействовать с водой, образуя кислоты или основания. Другие оксиды могут быть растворимыми или нерастворимыми в воде, и способность растворения также зависит от их химического состава.
Химические реакции, в которых участвуют оксиды, могут быть разнообразными. Оксиды могут вступать в реакцию с кислотами, основаниями и металлами. Например, оксид железа (Fe2O3) может взаимодействовать с углеродом (C) при высоких температурах, образуя железо и угарный газ.
Таким образом, оксиды - это важные химические соединения, которые играют важную роль во многих химических процессах. Изучение свойств и реакций оксидов позволяет лучше понять мир химии и его применение в различных областях науки и технологии.