Изомерия - это фундаментальное понятие в химии, которое описывает связь между различными молекулами, имеющими одинаковую химическую формулу, но различную структуру. Изучение изомерии имеет огромное значение для понимания основ химических реакций и построения сложных органических соединений.
Существует несколько видов изомерии, включая структурную, геометрическую, оптическую и радикальную изомерию. Структурная изомерия возникает, когда у молекулы одного вещества есть разные структуры. Например, изомеры молекулы пропана CH3CH2CH3 - это изо-бутан CH3CH(CH3)CH3 и изо-пропан C(CH3)3.
Определение изомеров может быть сложным процессом, но для этого существуют различные методы. В качестве примера можно привести газовую хроматографию. Этот метод позволяет разделить смесь компонентов и идентифицировать их на основе их удельных времен удерживания и других характеристик. Другим методом может быть использование ядерного магнитного резонанса (ЯМР), который позволяет изучать структурные особенности молекулы и выявлять различия между изомерами.
Знание о наличии и типах изомерии является ключевым элементом во многих областях химии, включая органическую и биохимию. При изучении и анализе соединений важно учитывать возможность наличия изомеров, поскольку они имеют разные свойства и поведение в химических реакциях. Понимание изомерии помогает сориентироваться в сложном мире химических соединений и лежит в основе многих научных открытий и применений в различных областях химии.
Что такое изомеры в химии?

Изомерия происходит из-за принципа неизменности связей между атомами и неизменности общего числового соотношения атомов разнородных элементов в молекуле. Изомеры могут различаться в трех основных аспектах - структуре, пространственной конфигурации и пропорциях изотопов.
Структурные изомеры имеют разные последовательности связей атомов. Например, изомер пентана может иметь прямую цепочку углеродных атомов или ветви. Структурные изомеры выделяются на основе атомного расположения и типа связей между атомами.
Пространственные конфигурации изомеров различаются по пространственному расположению атомов в молекуле. Например, 2-хлорбутан имеет два изомера - галоген и энантиомер. Галоген имеет атомы хлора на одной стороне молекулы, а энантиомер - на другой.
Изомеры могут также различаться в пропорциях изотопов, то есть в распределении атомов с различным числом нейтронов. Например, изотопный изомер водорода - дейтерий имеет вместо протона в атоме водорода нейтрон. Это приводит к некоторым специфическим свойствам и химическим реакциям.
| Тип изомерии | Пример |
|---|---|
| Структурная изомерия | Прямая цепь vs. замещенная цепь в углеводороде |
| Пространственная конфигурация | Галоген vs. энантиомер в аминовом соединении |
| Изотопная изомерия | Водород vs. дейтерий в молекуле воды |
Изомерия имеет большое значение в химии, поскольку изомеры могут иметь различные свойства и реакционную активность. Поэтому, понимание изомерии и способов ее определения является важным аспектом для химиков в исследованиях и применениях химических соединений.
Определение понятия "изомеры"
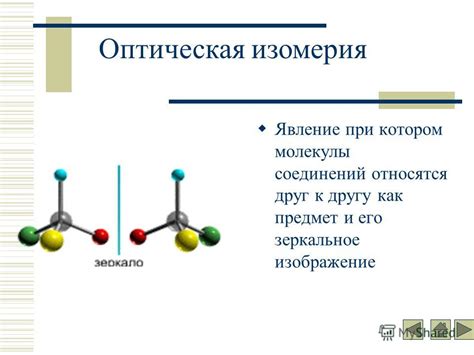
Существуют различные виды изомерии: структурная, геометрическая, оптическая и радикальная. Структурная изомерия возникает, когда атомы и группы атомов соединения имеют различное порядковое расположение. Геометрическая изомерия возникает, когда существует возможность различного расположения групп атомов относительно двойной или тройной связи. Оптическая изомерия возникает в результате наличия асимметричного атома, что приводит к наличию оптически активных изомеров. Радикальная изомерия возникает, когда изомеры имеют различное разделение электронных пар и свободных радикалов.
Определение изомеров в химии - это важный шаг к пониманию связей между структурой и свойствами органических соединений. Изучение изомеров помогает углубить знания о строении молекул и взаимодействии различных функциональных групп в химических реакциях.
Изомерия является широко распространенным явлением в химии, и понимание ее принципов играет важную роль в различных областях, таких как фармацевтическая химия, материаловедение и органическое синтез.
Основные принципы изомерии
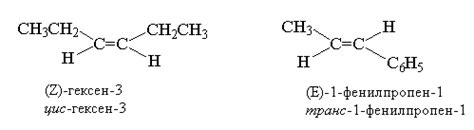
Главными принципами изомерии являются:
- Структурная изомерия: это самый общий тип изомерии, при котором молекулы отличаются по своей структуре. Это может быть связано с разными пространственными расположениями атомов или разным порядком соединения.
- Изомерия геометрическая: в этом случае молекулы имеют одну и ту же последовательность атомов, но отличаются конфигурацией групп, связанных с двойной связью. Такие изомеры получаются в результате невозможности свободного вращения вокруг двойной связи.
- Оптическая изомерия: возникает, когда молекулы имеют одну и ту же структуру и последовательность атомов, но отличаются пространственным расположением вокруг атомов симметрии. Такие изомеры называются энантиомерами и обладают оптической активностью.
- Изотопическая изомерия: это случай, когда изомеры различаются по количеству и расположению изотопов атомов в молекуле. Это связано с наличием в молекуле атомов одного элемента с различными массами.
Знание основных принципов изомерии позволяет химикам лучше понять и предсказывать свойства химических соединений, а также разрабатывать новые соединения с нужными свойствами и функциональностью.
Классификация изомеров

1. Структурные изомеры - это изомеры, которые отличаются внутренней структурой своих атомов. В рамках структурных изомеров можно выделить:
- Цепные изомеры - молекулы, которые имеют различную последовательность связей между атомами, создавая разные углеводородные цепи. Примеры цепных изомеров: н-бутан и изо-бутан.
- Групповые изомеры - молекулы, которые содержат различные функциональные группы, связанные с основной скелетной структурой. Примеры групповых изомеров: этиловый спирт и метиловый эфир.
- Позиционные изомеры - молекулы, которые отличаются расположением функциональных групп или двойных связей в молекуле. Примеры позиционных изомеров: орто-, мета- и паразолофенилендиамин.
- Функциональные изомеры - молекулы, которые имеют одинаковую молекулярную формулу, но различаются в свойствах и реакционной способности. Примеры функциональных изомеров: альдегиды и кетоны.
2. Конформационные изомеры - это изомеры, которые отличаются пространственным расположением атомов в трехмерном пространстве. Конформационные изомеры могут существовать в различных конформациях, которые обусловлены вращением связи или переворотом групп атомов вокруг определенных осей.
3. Оптические изомеры - это изомеры, которые отличаются способностью взаимодействовать со светом. Оптические изомеры могут быть разделены на две группы: энантиомеры и диастереомеры.
Различные виды изомеров имеют разные свойства и могут показывать различные химические реакции. Поэтому понимание и классификация изомеров является важным аспектом в изучении органической химии.
Структурные изомеры
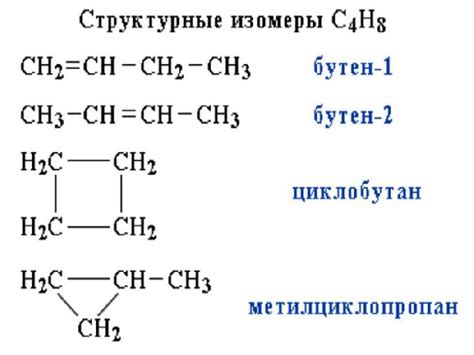
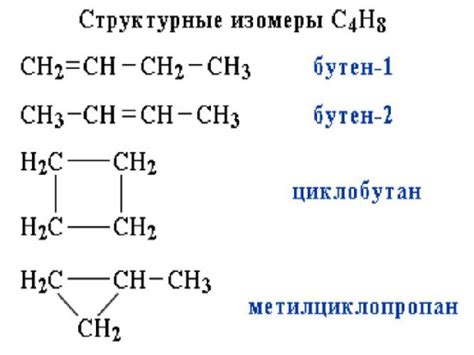
Существует несколько типов структурных изомеров:
- Цепные изомеры - отличаются расположением атомов в углеродной цепи. Например, изомеры бутана - н-бутан и изобутан.
- Функциональные группы - отличаются наличием или отсутствием функциональной группы. Например, альдегиды и кетоны, такие как ацетон и пропанон.
- Угловые изомеры - отличаются угловым расположением атомов. Например, цис- и транс-изомеры в алкенах.
- Циклические изомеры - отличаются вида цикла молекулы. Например, циклогексан и циклопентан.
Определение структурных изомеров проводится с помощью анализа молекулярной структуры и использования различных спектральных методов, таких как ЯМР, ИК-спектроскопия и масс-спектрометрия.
Понимание структурных изомеров в химии имеет важное значение для понимания свойств и реакций органических соединений, а также для разработки новых лекарственных препаратов и материалов.
Функциональные изомеры

Наиболее распространенным примером функциональных изомеров являются альдегиды и кетоны. Оба типа органических соединений содержат функциональную группу карбонильного атома, но они отличаются расположением этой группы в молекуле. Альдегиды обычно содержат карбонильную группу (CHO) в начале молекулы, в то время как кетоны содержат ее в середине молекулы.
Функциональные изомеры могут иметь различные свойства, включая физические и химические. Например, метанол и этанол - это два функциональных изомера, которые отличаются в одной функциональной группе: метанол содержит одну гидроксильную группу (-OH), в то время как этанол содержит две гидроксильные группы (-OH). В результате этого различия в функциональных группах, метанол и этанол имеют разные физические свойства, такие как температура кипения и растворимость.
Иногда функциональные изомеры могут иметь схожие свойства и функции, но все же различаться в некоторых аспектах. Например, пропанол и изопропанол являются функциональными изомерами, так как они имеют одинаковую химическую формулу C3H8O, но их гидроксильные группы расположены по-разному. Оба соединения обладают способностью растворяться в воде и плохо смешиваться с ним, но пропанол имеет более низкую температуру кипения и плотность, чем изопропанол.
Определение функциональных изомеров обычно включает сравнение структуры и свойств соединений, а также использование методов физического и химического анализа, таких как спектроскопия и хроматография. Изучение функциональных изомеров играет важную роль в химии, так как оно помогает понять связь между структурой и свойствами органических соединений и имеет практическое значение во многих областях, включая фармацевтику, пищевую промышленность и материаловедение.
Строение и геометрия изомеров

Строение изомеров определяется атомным составом и последовательностью соединений в молекуле. Различные атомы и связи между ними могут быть упорядочены по-разному в разных изомерах. Например, углеродные атомы могут иметь различные расположения и связи друг с другом.
Геометрия изомеров определяется пространственным расположением атомов в молекуле. Углеродные атомы могут быть связаны друг с другом в разных пространственных ориентациях, что приводит к различным геометрическим изомерам. Например, два изомера могут иметь разное расположение группы функциональных групп относительно друг друга.
Для определения строения и геометрии изомеров используются различные методы. Одним из основных методов является спектроскопия - исследование взаимодействия вещества с электромагнитным излучением. Спектры поглощения и рассеяния позволяют определить наличие и тип функциональных групп, а спектры ядерного магнитного резонанса (ЯМР) позволяют определить расположение атомов в молекуле.
| Метод | Описание |
|---|---|
| Инфракрасная спектроскопия | Измерение поглощения инфракрасного излучения веществом для определения функциональных групп и типов связей. |
| Масс-спектрометрия | Анализ ионов, образованных изучаемым веществом при его ионизации, для определения молекулярной массы и структуры. |
| ЯМР-спектроскопия | Измерение спектров ЯМР для определения типа и расположения атомов в молекуле. |
Исследование строения и геометрии изомеров важно для понимания их свойств и взаимодействий с другими веществами. Это позволяет разрабатывать новые материалы, лекарственные препараты и улучшать существующие процессы и технологии в различных областях науки и промышленности.
Примеры изомеров в химии
Другим примером структурной изомерии являются моносахариды, такие как глюкоза и фруктоза. У них одинаковая формула C6H12O6, но разные атомные упорядочения. Это приводит к разнице в свойствах и функциях этих молекул.
Конформационная изомерия связана с различными пространственными конформациями молекулы. Например, циклохексан может существовать в форме плоского стула или бочки, что приводит к наличию конформационных изомеров.
Оптическая изомерия возникает из-за возможности различного вращения плоскости поляризации света вокруг хиральных центров. Примерами являются D- и L- изомеры аминокислот, которые отличаются своей оптической активностью.
Это лишь некоторые примеры изомеров, и в химии существует множество других случаев изомерии. Понимание и определение изомеров является важным аспектом химических исследований и позволяет более глубоко понять свойства и реакционную способность веществ.
Пример 1: Изомерия алканов

Структурная изомерия подразумевает наличие различных расположений атомов в молекулах алканов. Например, пентан (C5H12) имеет три изомера: нормальный пентан, изо-пентан и неопентан. В нормальном пентане атомы углерода связаны одним и тем же образом, в изо-пентане один из атомов углерода имеет отклоненное от цепи положение, а в неопентане все атомы углерода находятся на одном уровне.
Многолетний вид изомерии возникает, когда молекулы могут быть перевернуты или вращены друг относительно друга. Например, гексан (C6H14) имеет два многолетних изомера, нормальный гексан и циклогексан. Нормальный гексан имеет прямую цепь из шести атомов углерода, а циклогексан имеет шесть атомов углерода, образующих кольцо.
Изомерия алканов имеет большое значение в органической химии, так как различные изомеры могут обладать различными физическими и химическими свойствами. Это может оказывать влияние на их реакционную способность, температуру кипения, плотность и другие характеристики. Поэтому для понимания химических реакций и свойств соединений важно учитывать изомерию.
Пример 2: Изомерия альдегидов и кетонов

Альдегиды и кетоны могут быть изомерными, если они содержат одну и ту же карбонильную группу, но различаются в расположении этой группы в молекуле. В случае альдегидов, карбонильная группа находится на первом углероде цепи, а в случае кетонов - на внутреннем углероде.
Давайте рассмотрим пример альдегида и его изомера-кетона:
| Альдегид | Кетон |
В данном примере, альдегидный изомер представлен формальдегидом (CH2O), где карбонильная группа находится на первом углероде цепи, и его кетонный изомер - ацетоном (CH3COCH3), где карбонильная группа находится на внутреннем углероде цепи.
Таким образом, изомерия альдегидов и кетонов представляет собой важное явление в органической химии. Понимание структуры и свойств изомеров позволяет ученым расширить свои знания о молекулярной структуре и реакционных свойствах соединений.
Пример 3: Изомерия аминов и аминоуксусных кислот
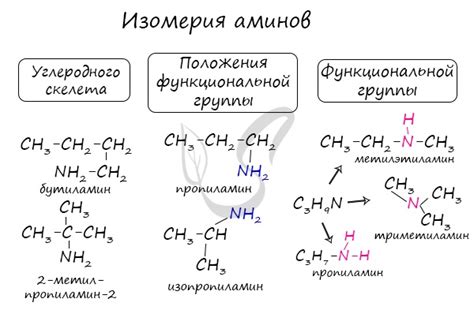
Аминоуксусные кислоты - это класс органических соединений, содержащих одну аминогруппу (-NH2) и одну карбоксильную группу (-COOH). Примером аминоуксусных кислот является глицин (C2H5NO2). Они являются ключевыми компонентами белков и участвуют во многих биологических процессах.
Изомерия аминов и аминоуксусных кислот может проявляться в различиях в одноатомного замещения, двухатомного перестроения, изменении расположения функциональных групп и т.д. Изомеры могут иметь разные физические свойства, химическую активность и биологическую активность, что делает их важными с точки зрения применений в медицине и фармацевтической промышленности.

