Связь – это интермолекулярное взаимодействие, которое удерживает атомы вещества вместе. Существует несколько видов связей, наиболее распространенными из которых являются ионная и ковалентная связь. Понимание различий между этими видами связи позволяет нам более глубоко понять химические взаимодействия и их роль в формировании свойств вещества.
Ионная связь возникает между атомами, когда один из них отдает электроны, а другой принимает их. В результате образуются ионы с положительным и отрицательным зарядами, которые притягиваются друг к другу силой электростатического притяжения. Такая связь образуется между атомами с большой разницей в электроотрицательности, например, между металлами и неметаллами.
Ковалентная связь, в свою очередь, возникает при совместном использовании электронов двумя атомами. В этом типе связи атомы образуют общие электронные пары, обратившиеся между ними. Таким образом, оба атома получают доступ к электронам другого атома и образуют стабильную молекулу. Ковалентная связь в основном образуется между атомами сравнительно схожей электроотрицательностью, как это можно увидеть в случае соединений неметаллических элементов.
В этой статье мы рассмотрим основные признаки и методы различения ионной и ковалентной связи. Мы поговорим о том, какие свойства и особенности имеют эти два типа связи, и как они влияют на химические реакции и структуру вещества. Узнавание этих различий поможет нам лучше понять химическую природу веществ и их свойств, а также их возможное влияние на человеческую жизнь и окружающую среду.
Определение ионной и ковалентной связи:

Ионная связь характеризуется переносом электронов от одного атома к другому, что приводит к образованию ионов с положительным и отрицательным зарядом. Ионы с разными зарядами притягиваются друг к другу, образуя кристаллическую решетку или сеть ионной связи. Такая связь обычно возникает между металлическими и неметаллическими элементами, такими как натрий и хлор в соли натрия хлорида (NaCl).
Ковалентная связь, с другой стороны, возникает, когда два атома делят пару электронов между собой. Образовавшаяся общая пара электронов образует электронное облако, которое окружает оба атома. Ковалентная связь часто возникает между неметаллическими элементами, такими как водород и кислород в молекуле воды (H2O).
Определение ионной и ковалентной связи основывается на различных химических и физических свойствах, таких как электроотрицательность, симметрия молекулы, проводимость и т. д. Химики исследуют эти свойства и используют различные методы, чтобы различить ионные и ковалентные связи и понять их природу и характеристики.
Основные признаки ионной связи
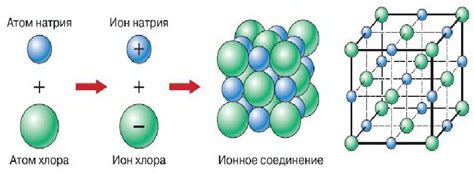
Основными признаками ионной связи являются:
- Образование ионов. В ионной связи атомы обладают электрическим зарядом и становятся ионами. Один атом отдает или получает электроны, что приводит к образованию положительно и отрицательно заряженных ионов.
- Сильное притяжение между ионами. В ионной связи происходит сильное притяжение между атомами с противоположными зарядами. Это притяжение обусловлено электростатическим взаимодействием между ионами и обладает большой силой.
- Кристаллическая структура. Вещества соединения, образованные ионной связью, имеют кристаллическую структуру. Ионы занимают определенные позиции в решетке, что обусловлено силой притяжения между ними.
- Высокая температура плавления и кипения. Ионные соединения обладают высокой температурой плавления и кипения из-за сильных взаимодействий между ионами.
Таким образом, ионная связь образуется при обмене электронами между атомами и характеризуется образованием ионов с противоположными зарядами, сильным притяжением между ними, кристаллической структурой и высокой температурой плавления и кипения.
Основные признаки ковалентной связи

Основные признаки ковалентной связи:
- Равномерное распределение электронов: В ковалентной связи электроны распределяются равномерно между атомами, что создает общую область электронной плотности. Это обусловлено совместным использованием электронов обоими атомами, чтобы достичь более стабильного энергетического состояния.
- Образование молекул: Ковалентная связь позволяет атомам объединяться и образовывать молекулы. В молекулярной структуре каждый атом имеет определенное количество соседей, к которым он связан ковалентной связью.
- Силы притяжения между атомами: Ковалентная связь создает силы притяжения между атомами, которые обеспечивают их структуру и устойчивость. Данные силы притяжения основаны на взаимодействии электронов и ядер атомов.
- Обмен и совместное использование электронов: При ковалентной связи происходит обмен и совместное использование электронов между атомами. Каждый атом предоставляет один или несколько электронов для создания общих областей электронной плотности между атомами.
- Образование ковалентных связей: Образование ковалентной связи происходит между атомами с непарными электронами в их внешних энергетических оболочках. Это происходит путем совместного использования электронов, чтобы каждому атому было надежнее и устойчивее.
Идентифицировать наличие ковалентной связи можно с помощью различных физических и химических методов, таких как спектроскопия, рентгеноструктурный анализ и химические реакции. Определение наличия ковалентной связи является важным шагом в понимании химических свойств и реакций молекул и соединений.
Методы различия ионной и ковалентной связи
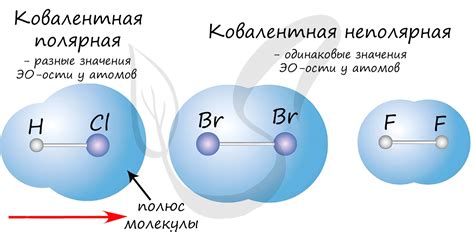
Ионная и ковалентная связи представляют собой основные типы химических связей между атомами. Различение между этими типами связей имеет важное практическое значение для понимания химической структуры и свойств веществ.
Существуют различные методы, которые можно использовать для определения, является ли связь ионной или ковалентной. Один из наиболее распространенных методов - это изучение электроотрицательности элементов.
Электроотрицательность - это мера атомной способности атома привлекать к себе электроны в химической связи. Если разница в электроотрицательности между атомами вещества большая, то связь скорее всего будет ионной. Если разница небольшая, то связь скорее всего будет ковалентной. Электроотрицательность элементов можно найти в таблице Менделеева.
Другой метод - это анализ формулы вещества. Если формула содержит металл и неметалл, то связь, скорее всего, будет ионной. Если формула состоит только из неметаллов, то связь может быть ковалентной.
Также можно использовать методы расчета энергии связи и определения геометрической структуры молекулы. Ионные связи обычно сопровождаются высокой энергией связи и характерным расстоянием между атомами. В ковалентных связях энергия связи может быть более низкой, и атомы располагаются ближе друг к другу.
Таким образом, изучение электроотрицательности элементов, анализ формулы вещества, расчет энергии связи и геометрической структуры молекулы можно использовать в комбинации для определения, является ли связь ионной или ковалентной. Это позволяет более глубоко понять характер взаимодействия атомов в веществе и его свойства.