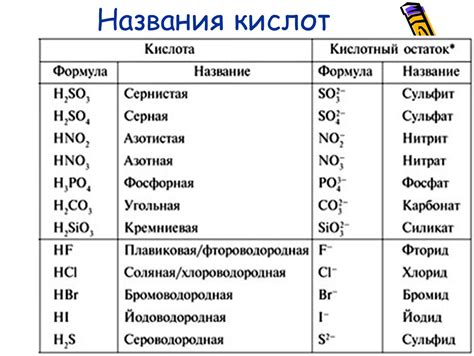
Кислоты - это вещества, которые могут отдавать протоны, образуя положительный ион, называемый катионом. Чтобы определить кислоту, можно использовать несколько методов. Один из них - изучение свойств растворов этих веществ.
Сначала можно провести эксперимент с индикаторами, такими как лакмус и реппен. Лакмус в кислотном растворе окрашивается в красный цвет, а в щелочном растворе - в синий. Реппен изменяет свой цвет при взаимодействии с различными кислотными и щелочными растворами.
Основания, с другой стороны, могут принимать протоны, образуя отрицательные ионы, называемые анионами. Определение оснований может быть проведено с использованием измерения pH-уровня раствора.
Если раствор имеет рН меньше 7, то он считается кислотным, а если он имеет рН больше 7, то он щелочной. Если рН равняется 7, то раствор является нейтральным. Это справедливо для водных растворов оснований, таких как гидроксид натрия и гидроксид калия.
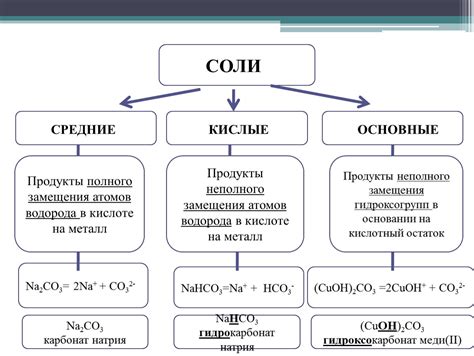
Соли образуются при реакции между кислотами и основаниями. Их можно определить с помощью специальных тест-полосок, которые меняют цвет при взаимодействии с ионами металла в солях. Также существуют методы, основанные на химических реакциях, которые позволяют определить наличие или отсутствие солей в растворе.
Оксиды - это неорганические вещества, состоящие из кислорода и одного или нескольких других элементов. Для определения оксидов можно использовать методы химического анализа, такие как реакции с растворами щелочей или кислот.
Основные способы определения кислоты
Один из способов определения кислоты является идентификация ее характерных химических свойств. Кислоты обычно имеют кислотный вкус, реагируют с основаниями, веществами, которые обладают щелочной природой, и образуют с ними соли и воду. Кроме того, кислоты могут образовывать газы при контакте с определенными веществами, такими как металлы или карбонаты.
Другим способом определения кислоты является использование индикаторов кислотности. Индикаторы - это вещества, которые изменяют свой цвет в зависимости от кислотности или щелочности раствора. Некоторые известные индикаторы кислотности включают бромтимоловый синий, лакмус и фенолфталеин. Путем добавления небольшого количества индикатора к раствору можно определить его кислотность или щелочность по изменению цвета.
Также существует метод окраски кислот. Кислоты могут быть окрашены определенными химическими веществами, которые образуют с ними характерные окраски. Например, сульфидная кислота может быть окрашена окрашенным раствором свинца, который образует черный цвет. Этот метод позволяет визуально определить наличие кислоты в растворе.
Таким образом, определение кислоты можно осуществить с помощью химических реакций и свойств кислотных соединений, использования индикаторов кислотности и метода окраски. Комбинированное использование этих методов позволяет точно определить кислотность раствора и выявить наличие кислоты.
| Метод | Принцип | Пример |
|---|---|---|
| Химические реакции и свойства | Реакция с основаниями и образование соли и воды | Реакция с гидроксидом натрия: |
| Индикаторы кислотности | Изменение цвета индикатора в зависимости от кислотности или щелочности | Фенолфталеин приобретает розовый цвет в кислой среде |
| Метод окраски | Образование характерной окраски в присутствии определенных химических веществ | Сульфидная кислота оказывается черного цвета при взаимодействии с окрашенным раствором свинца |
Использование индикаторов

Один из наиболее распространенных индикаторов - лакмус. Он имеет синий цвет в щелочной среде и красный цвет в кислотной среде. Лакмус удобно использовать для определения кислот и оснований путем простого обмакивания его в растворе и наблюдения за изменением цвета.
Оксигенация - индикатор, который меняет цвет в зависимости от близости окружающей среды к конкретному pH. Оксигенация широко применяется для определения pH в промышленности, медицине и экологии.
Универсальные индикаторы - это смеси нескольких индикаторов, которые меняют цвет в зависимости от pH среды в определенном интервале. Они обычно представляют собой растворы, которые можно добавлять к образцу для получения цветового показателя его pH.
Индикаторы являются незаменимым инструментом при определении кислот, оснований, солей и оксидов, так как они позволяют быстро и точно определить pH среды, не требуя сложных инструментов или процедур.
Использование фенолфталеина
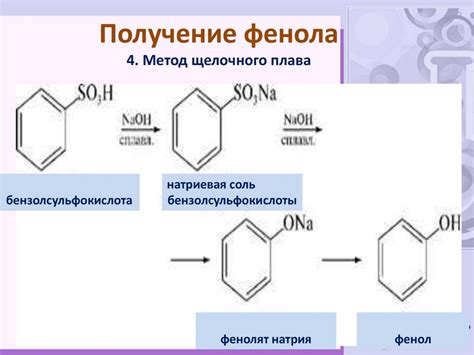
Для использования фенолфталеина необходимо добавить несколько капель индикатора в раствор, который нужно проверить. Если раствор кислый, он останется безцветным. Если раствор щелочной, он станет ярко-розовым.
Но следует учитывать, что фенолфталеин нейтральный перед pH 8,2 и в данном случае он остается без яркости.
Использование фенолфталеина является простым и удобным способом определения кислотности или щелочности растворов. Он широко используется в химическом анализе и лабораторной практике. Однако, при использовании фенолфталеина необходимо быть внимательным и следовать инструкциям по использованию, чтобы получить точные результаты.
Основные способы определения основания
Кислотно-основные титрования: эта методика основана на проведении титрования основания с известной кислотной раствором. При добавлении кислоты к основанию происходит химическая реакция, в результате которой можно определить концентрацию основания.
Фенольфталеин: это индикатор, который меняет свой цвет в зависимости от pH раствора. Он обычно используется для определения основания. Если фенольфталеин окрашивает раствор в розовый цвет, это указывает на наличие основания.
Осадка: добавление ионосодержащего раствора, такого как иод или сульфат меди(II), к раствору, содержащему основание, может вызвать образование осадка. Появление осадка указывает на присутствие основания.
Теплообразование: во время реакции основание может выделять тепло. Измерение увеличения температуры раствора после добавления основания может помочь определить его присутствие.
Электролитическая диссоциация: основания образуют ионы гидроксида в водных растворах. Использование методов электролиза или измерение электропроводности раствора можно применять для определения основания.
Эти методы определения основания могут быть использованы в лабораторных условиях или в повседневной жизни для определения присутствия оснований в различных материалах или реакциях.
Использование кислотно-основного титрования

Для проведения кислотно-основного титрования необходимы следующие компоненты:
- Титрант - раствор кислоты или основания известной концентрации, который добавляется в реакционную смесь для определения ее концентрации.
- Индикатор - вещество, меняющее свой цвет при достижении эквивалентности реакции. Индикатор выбирается в зависимости от pH реакционной среды и типа проводимой титрования.
- Титранд - реакционная смесь, содержащая анализируемую кислоту, основание или соль, а также индикатор.
- Бюретка - специальное устройство, предназначенное для точного дозирования титранта в титранд.
Процесс проведения кислотно-основного титрования состоит из нескольких шагов:
- Подготовка титранда - взвешивание или измерение необходимой массы анализируемой вещества, его растворение в определенном объеме растворителя.
- Добавление индикатора в титранд - в зависимости от выбранного индикатора, его необходимо добавить в титранд последним шагом перед проведением титрования.
- Добавление титранта в титранд - с помощью бюретки титрант добавляется по мере взаимодействия с анализируемым веществом до появления изменения цвета индикатора, которое указывает на достижение эквивалентности реакции.
- Расчет концентрации анализируемого вещества - по известной концентрации титранта и объему, необходимому для достижения эквивалентности реакции, можно определить концентрацию анализируемого вещества.
Кислотно-основное титрование является надежным и точным методом определения концентрации кислот, оснований и их солей. Он широко используется в химическом анализе и лаборатории для контроля качества и исследовательских целей.
Использование индикаторов

Индикаторы - это вещества, которые меняют свой цвет в зависимости от кислотно-щелочного состояния раствора. Их применение позволяет быстро и наглядно определить характер раствора.
Для определения кислоты используются индикаторы, которые обычно окрашивают растворы в красный или оранжевый цвет. Примерами таких индикаторов являются метиловый оранжевый, фенолфталеин и лакмус.
Для определения основания используются индикаторы, окрашивающие растворы в синий или зеленый цвет. Например, бромтимоловый синий и универсальный индикатор помогают быстро определить щелочной раствор.
Соли и оксиды обычно не меняют цвет растворов, поэтому для их определения используются другие методы, такие как реакции обмена и нейтрализационные реакции.
Использование индикаторов является простым и эффективным способом определения кислоты, основания, солей и оксидов. Они позволяют проводить анализ с минимальными затратами времени и сил, обеспечивая при этом высокий уровень точности и надежности результатов.
Основные способы определения соли
1. Метод образования осадка. Он основан на реакции между раствором соли и соответствующим реактивом, которая приводит к образованию осадка. Осадок можно определить по его цвету, физическим свойствам или с помощью химических реакций.
2. Метод окраски. Он заключается в том, чтобы добавить к раствору соли специальный индикатор, который изменяет свой цвет в присутствии определенного катиона или аниона. По изменению цвета можно определить наличие соли.
3. Метод электролиза. Он используется для определения соли, состоящей из металлического катиона. С помощью электролиза можно разложить соль на металл и кислотный радикал. Затем по металлу или кислотному радикалу можно определить исходную соль.
4. Метод титрования. Он применяется для определения содержания соли в растворе с помощью титрования раствором известной концентрации. Реакция титрования происходит между солью и титратором. По количеству титратора, затраченного на реакцию, можно определить концентрацию соли.
Эти методы являются основными для определения солей и используются в химическом анализе для идентификации и количественного определения солей различных металлов и кислотных радикалов.
Использование растворимости

Растворимость закономерно изменяется для различных классов веществ в зависимости от их химических свойств. Например, кислоты обычно растворяются в воде и образуют водные растворы с кислыми свойствами. Они проявляют кислотность, т. е. способность отдавать H+ и формировать положительные ионы в растворе. С другой стороны, основания растворяются в воде и образуют щелочные растворы, которые обладают способностью отдавать OH- и образовывать отрицательные ионы.
Соли, в свою очередь, могут быть разделены на растворимые и нерастворимые. Растворимые соли образуют прозрачные растворы, в то время как нерастворимые соли выделяются в виде осадка или проявляют низкую степень растворимости. Оксиды, в зависимости от типа химической реакции, могут проявлять свою растворимость или нерастворимость.