Определение массы вещества по числу структурных частиц является одной из важных задач в химии. Это необходимо для расчетов реакций, определения концентрации растворов и многих других процессов. Существует несколько методов, которые позволяют определить массу вещества с высокой точностью, основываясь на числе структурных частиц.
Один из основных методов - метод стехиометрии. В химии стехиометрия - это наука о количественных соотношениях между веществами, которые проходят химические реакции. Для определения массы вещества по числу структурных частиц используется эта наука. Она позволяет установить соотношение между числом структурных частиц и массой вещества с помощью химических уравнений.
К примеру, рассмотрим реакцию сгорания метана (CH4). В уравнении реакции мы видим, что один молекулы метана распадается на одну молекулу углекислого газа (CO2) и две молекулы воды (H2O). Таким образом, если мы знаем массу метана, то мы можем определить массу углекислого газа и воды, и наоборот.
Методы определения массы вещества по числу структурных частиц

Существует несколько методов определения массы вещества, включая химические и физические методы. Один из наиболее распространенных методов – гравиметрический анализ. Этот метод основан на измерении потери или прироста массы при проведении химических реакций или других процессов, связанных с исследуемым веществом.
Также часто используется метод титрования, основанный на измерении объема раствора, необходимого для полного реагирования с исследуемым веществом. По известному соотношению между объемом раствора и массой вещества можно определить массу исследуемого образца.
Методы определения массы вещества также могут быть связаны с использованием инструментов анализа, таких как спектрометрия и хроматография. Эти методы позволяют определить массу вещества путем измерения определенных физических или химических свойств вещества, которые зависят от его массы.
Примером применения методов определения массы вещества может быть анализ образцов почвы на содержание различных элементов, таких как азот, фосфор и калий. Эти элементы являются важными питательными веществами для растений, и их содержание в почве может быть определено путем измерения массы образцов и применения соответствующих методов анализа.
Использование формулы молярной массы
Для использования этой формулы необходимо знать количество структурных частиц (например, атомов или молекул) в веществе и их молярные массы. Формула молярной массы выглядит следующим образом:
Молярная масса = масса / количество частиц
Для примера рассмотрим расчет молярной массы глюкозы (C6H12O6). Известно, что глюкоза состоит из 6 атомов углерода (масса атома углерода 12,01 г/моль), 12 атомов водорода (масса атома водорода 1,01 г/моль) и 6 атомов кислорода (масса атома кислорода 16,00 г/моль).
Следуя формуле молярной массы, суммируем массы всех атомов в глюкозе:
Молярная масса глюкозы = (масса атома углерода * 6) + (масса атома водорода * 12) + (масса атома кислорода * 6)
Молярная масса глюкозы = (12,01 г/моль * 6) + (1,01 г/моль * 12) + (16,00 г/моль * 6)
Молярная масса глюкозы = 180,18 г/моль
Таким образом, молярная масса глюкозы равна 180,18 г/моль. Это означает, что в 1 моле глюкозы содержится 180,18 грамма данного вещества.
Использование формулы молярной массы позволяет определить массу вещества по известному количеству структурных частиц. Она является важным инструментом для химиков и исследователей при проведении различных расчетов и экспериментов.
Применение метода стехиометрии

В основе метода стехиометрии лежит понятие молярных соотношений, которые основываются на химических уравнениях реакций. Молярные соотношения определяют связь между количеством вещества в реакции и их массой.
Для применения метода стехиометрии необходимо знать химическое уравнение реакции, в которой участвует исследуемое вещество или вещества. Далее, используя массы известных компонентов реакции и их молярные соотношения, можно рассчитать массу исследуемого вещества.
Применение метода стехиометрии может быть наглядно представлено в виде таблицы, где приводятся массы исходных компонентов реакции, их молярные соотношения и рассчитываемая масса исследуемого вещества. Такая таблица помогает систематизировать данные и облегчает расчеты.
Примером применения метода стехиометрии может быть рассмотрение реакции сгорания спирта. Если известна масса сжигаемого спирта и его химическое уравнение реакции, то можно рассчитать массу выделяющегося углекислого газа или воды. Таким образом, метод стехиометрии позволяет определить массу вещества, которое образуется или исчезает в результате химической реакции.
| Компонент реакции | Масса (г) | Молярное соотношение |
|---|---|---|
| Спирт | 10 | 1 моль = 46 г |
| Углекислый газ | ? | 1 моль = 44 г |
Используя молярное соотношение между спиртом и углекислым газом (1:1), можно рассчитать массу углекислого газа:
Масса углекислого газа = (10 г спирта) * (1 моль углекислого газа / 1 моль спирта) * (44 г / 1 моль углекислого газа) = 440 г
Таким образом, при сжигании 10 г спирта образуется 440 г углекислого газа.
Метод стехиометрии является надежным и точным способом определения массы вещества по числу структурных частиц. Он широко применяется в химических исследованиях, анализе веществ и контроле качества продукции.
Примеры определения массы вещества
Определение массы вещества можно осуществить с использованием различных методов и техник. Рассмотрим несколько примеров:
- Определение массы с помощью гравиметрического метода. Этот метод основан на установлении разности массы до и после проведения химической реакции. Например, для определения массы меди в образце можно использовать реакцию с нитратом свинца и измерение массы полученного осадка.
- Определение массы с помощью взаимодействия с известным веществом. Например, для определения массы кислорода в образце можно использовать реакцию с известным количеством водорода и измерение массы образовавшейся воды.
- Определение массы с помощью электрохимических методов. Например, с использованием электролиза можно определить массу вещества путем измерения прошедшего через электролит тока и заряда электрода.
- Определение массы с помощью спектрального анализа. Спектральный анализ позволяет определить массу вещества путем измерения интенсивности излучения, испускаемого атомами или молекулами при возбуждении.
Каждый из этих методов имеет свои преимущества и ограничения, и выбор конкретного метода зависит от свойств и характеристик исследуемого вещества.
Определение массы вещества через количество атомов
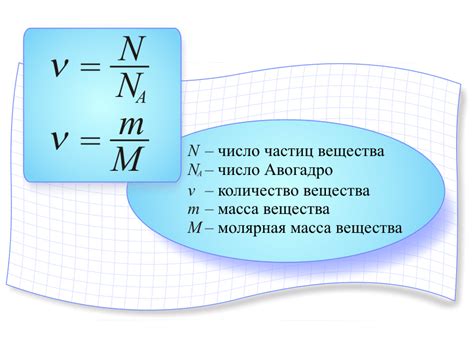
Для определения массы вещества через количество атомов необходимо знать молярную массу данного вещества. Молярная масса – это масса одного моля вещества, выраженная в граммах.
Для расчета массы вещества по количеству атомов необходимо выполнить следующие шаги:
- Узнать количество атомов данного вещества.
- Узнать молярную массу данного вещества.
- Умножить количество атомов на молярную массу.
Например, предположим у нас есть 2 молекулы воды (H2O), и мы хотим определить их массу. Зная, что одна молекула H2O содержит 3 атома (2 атома водорода и 1 атом кислорода) и молярная масса воды равна 18 г/моль, мы можем определить массу вещества следующим образом:
Масса вещества = количество атомов x молярная масса = 2 молекулы x 3 атома/молекула x 18 г/моль = 108 г
Таким образом, вес 2 молекул воды составляет 108 г.
Используя этот метод, вы можете определить массу вещества на основе числа атомов в нем. Это особенно полезно при работе с химическими соединениями и молекулами.
Использование массы одной структурной частицы

Для применения этого метода необходимо знать массу одной структурной частицы вещества. Эта величина может быть измерена с помощью различных инструментов и методов, таких как электронные весы или спектрометрия.
После измерения массы одной структурной частицы можно определить массу всего вещества. Для этого необходимо умножить количество структурных частиц на их массу. Например, если масса одной структурной частицы равна 2 грамма, а количество частиц равно 5, то масса всего вещества будет равна 10 граммам.
Использование массы одной структурной частицы позволяет быстро и удобно определить массу вещества без необходимости проведения сложных химических или физических экспериментов. Однако следует учитывать, что данная методика подходит только для веществ, у которых все структурные частицы имеют одинаковую массу.