Молярная масса является одной из важных характеристик вещества и используется в химии для расчетов различных физико-химических процессов. Она позволяет определить массу одной молекулы или формулы вещества и является важным понятием для понимания и изучения химических реакций.
Для определения молярной массы вещества необходимо знать состав и количество атомов каждого элемента, входящих в его формулу. Методы расчета молярной массы могут быть разными в зависимости от структуры вещества и его формулы.
В данной статье мы рассмотрим простой способ определения молярной массы вещества для 8 класса, который позволит легко и понятно освоить данное понятие.
Молярная масса: понятие и значение в химии

Молярная масса позволяет сравнивать массы различных веществ и определить их количество частиц в молярных единицах. Она также позволяет рассчитать массовое отношение компонентов в химической реакции, что необходимо для определения стехиометрии реакции.
Прежде чем рассчитывать молярную массу, необходимо знать атомные массы элементов, из которых состоит вещество. Атомная масса определяется по табличным данным и указывается в атомных единицах (аму).
Чтобы рассчитать молярную массу вещества, необходимо узнать количество атомов каждого элемента в молекуле и умножить его на его атомную массу. Затем полученные значения складываются и получается молярная масса вещества.
Молярная масса используется для решения различных задач в химии. Например, она позволяет определить количество вещества, зная его массу, и наоборот. Также молярная масса позволяет рассчитать массу растворенного вещества в растворе и определить степень окисления элементов в соединении.
Знание молярной массы помогает понять, какие химические реакции происходят, какие вещества участвуют в реакции и в каких количествах. Это важная информация для проведения химических экспериментов и подготовки химических реакций.
Значение понятия "молярная масса"

Молярная масса является важной величиной в химии, так как она позволяет проводить различные расчеты в химических реакциях. Например, молярная масса используется для определения количества вещества, вычисления стехиометрических коэффициентов, а также для определения массы протонов, нейтронов и электронов в атоме.
Обычно молярная масса выражается в г/моль и указывается с помощью символа "М" после числа. Например, молярная масса воды равна 18 г/моль, что означает, что в одной молекуле воды содержится 18 граммов вещества.
Молярная масса может быть вычислена путем сложения атомных масс всех атомов, входящих в молекулу вещества. Для этого используются данные из периодической системы элементов, где указаны атомные массы всех химических элементов.
Значение молярной массы позволяет исследовать и понимать химические процессы, происходящие веществах, и делает возможным проведение различных расчетов и экспериментов в химии.
Формула для расчета молярной массы вещества
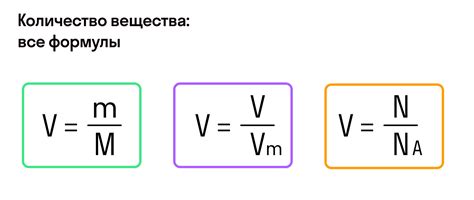
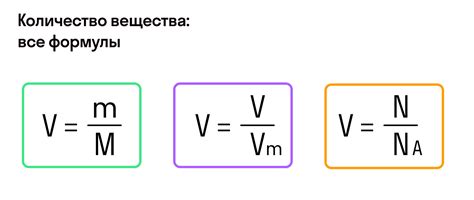
Молярная масса вещества определяется как масса одного моля вещества. Она выражается в г/моль. Для расчета молярной массы вещества необходимо знать массу одного атома каждого элемента, входящего в состав вещества, а также их количество.
Формула для расчета молярной массы вещества выглядит следующим образом:
Молярная масса = (масса первого элемента × количество атомов первого элемента) + (масса второго элемента × количество атомов второго элемента) + ... + (масса n-го элемента × количество атомов n-го элемента)
Например, для расчета молярной массы молекулы воды (H2O), необходимо знать массу водорода (H) и кислорода (O). Масса водорода равна приблизительно 1 г/моль, а масса кислорода примерно равна 16 г/моль. Количество атомов водорода равно 2, а количество атомов кислорода равно 1. Подставляя эти значения в формулу, получаем:
Молярная масса воды = (1 г/моль × 2) + (16 г/моль × 1) = 18 г/моль
Таким образом, молярная масса воды составляет 18 г/моль.
Примеры расчета молярной массы
Давайте рассмотрим несколько примеров по расчету молярной массы вещества:
1. Рассчитаем молярную массу молекулы воды (H2O).
Согласно периодической системе, атом водорода (H) имеет атомную массу 1, а атом кислорода (O) - 16. В молекуле воды содержится 2 атома водорода и 1 атом кислорода.
Молярная масса воды равна (2*1) + (1*16) = 2 + 16 = 18 г/моль.
2. Рассчитаем молярную массу углекислого газа (CO2).
Согласно периодической системе, атом углерода (C) имеет атомную массу 12, а атом кислорода (O) - 16. В молекуле углекислого газа содержится 1 атом углерода и 2 атома кислорода.
Молярная масса углекислого газа равна (1*12) + (2*16) = 12 + 32 = 44 г/моль.
3. Рассчитаем молярную массу серной кислоты (H2SO4).
Согласно периодической системе, атом водорода (H) имеет атомную массу 1, а атом серы (S) - 32, а атом кислорода (O) - 16. В молекуле серной кислоты содержится 2 атома водорода, 1 атом серы и 4 атома кислорода.
Молярная масса серной кислоты равна (2*1) + (1*32) + (4*16) = 2 + 32 + 64 = 98 г/моль.
Вы можете использовать эти примеры для понимания и расчета молярной массы других веществ.
Значение молярной массы в решении химических задач

Молярная масса определяется путем сложения атомных масс всех атомов, входящих в состав молекулы. Для определения молярной массы обычно используют таблицу атомных масс элементов, где указаны массы атомов каждого элемента. Чтобы вычислить молярную массу, нужно умножить числа атомных масс элементов на их коэффициенты в формуле вещества и сложить полученные значения.
Знание молярной массы помогает провести ряд расчетов. Например, если известна молярная масса вещества и его масса, можно вычислить количество вещества, используя формулу: количество вещества = масса / молярная масса. Также, зная массу вещества и количество вещества, можно определить молярную массу по формуле: молярная масса = масса / количество вещества.
| Примеры решения задач |
|---|
| 1. Найдите массу 0,5 моль воды (H2O). |
| Решение: Молярная масса воды равна сумме массы двух атомов водорода (2 * 1,01 г/моль) и одного атома кислорода (16 г/моль): 2 * 1,01 г/моль + 16 г/моль = 18,02 г/моль. Масса 0,5 моль воды будет равна: 0,5 моль * 18,02 г/моль = 9,01 г. |
| 2. Найдите количество молей серной кислоты (H2SO4) в 100 г вещества. |
| Решение: Молярная масса серной кислоты равна сумме массы двух атомов водорода (2 * 1,01 г/моль), одного атома серы (32,07 г/моль) и четырех атомов кислорода (4 * 16 г/моль): 2 * 1,01 г/моль + 32,07 г/моль + 4 * 16 г/моль = 98,09 г/моль. Количество молей серной кислоты в 100 г вещества равно: 100 г / 98,09 г/моль = 1,02 моль. |
Знание значения молярной массы позволяет проводить различные расчеты в химии и уточнить количество вещества или массу вещества в химической реакции. Оно является основой для понимания и решения многих химических задач.
Применение молярной массы в повседневной жизни

- Определение количества вещества: Молярная масса позволяет определить количество вещества вещества по его массе. Например, она может быть использована для определения количества пищевых добавок в продуктах питания для контроля их безопасности.
- Планирование реакций: Знание молярной массы позволяет планировать реакции и оптимизировать количество реагентов, чтобы достичь желаемого результата. Например, при приготовлении растворов или создании новых материалов.
- Разработка лекарств: Молярная масса вещества играет важную роль в разработке лекарств. Она используется для определения дозировки, вычисления концентрации и контроля качества лекарственных препаратов.
- Оценка загрязнений: Молярная масса используется для определения концентрации загрязняющих веществ в воздухе, воде или почве. Это позволяет оценить степень загрязнения и принять необходимые меры для защиты окружающей среды.
Таким образом, знание молярной массы вещества имеет практическое значение и может помочь нам принимать обоснованные решения в повседневной жизни, связанные с химическими процессами и веществами.