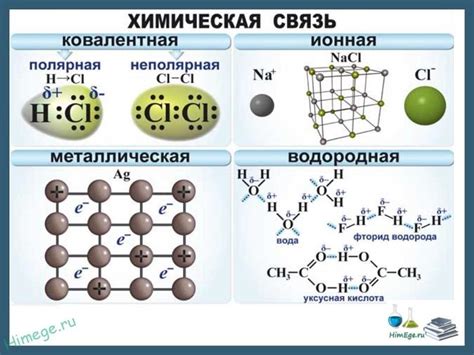
Ионная связь – одна из основных форм химической связи, которая возникает между атомами разноименных ионов. По своей сути ионная связь представляет собой притяжение электрически заряженных частиц, именуемых ионами, друг к другу. Ионами в ионной связи могут быть как положительно заряженные, так и отрицательно заряженные элементы.
Для более точной оценки наличия ионной связи между атомами используются различные методы исследования. Например, одним из таких методов является рентгеноструктурный анализ, который позволяет определить атомные координаты в кристаллической решетке соединения и выявить наличие ионной связи. Другим методом является спектроскопия, позволяющая изучить энергетические уровни атомов и их взаимодействие в соединении.
Общая информация о ионной связи
Ионная связь характеризуется высокой прочностью и точностью расположения частиц в кристаллической решетке. Это объясняет большое количество соединений, образующихся именно из-за ионной связи, таких как соли и многие минералы.
Существует ряд факторов, которые влияют на возникновение ионной связи. Один из них - разность электроотрицательности атомов или ионов, образующих связь. Чем больше разность электроотрицательности, тем сильнее будет ионная связь. Еще одним фактором является размер ионов. Чем меньше ион, тем сильнее ионное притяжение. Кроме того, ионная связь может возникать при образовании комплексных соединений или при сопряжении с другими химическими способностями.
Определить наличие ионной связи можно с помощью различных методов и признаков. Например, если вещество образует кристаллическую решетку, содержит металлы или кислород, обладает высокими точками плавления и кипения, а также имеет хорошую проводимость электричества, то это может указывать на наличие ионной связи.
Ионная связь имеет широкий спектр применений в различных областях, включая химию, биологию, физику и материаловедение. Понимание основ ионной связи помогает углубить знания в этих областях и применить их в практических задачах.
Определение понятия "ионная связь"
Ионная связь характеризуется следующими признаками:
- Высокая электроотрицательность одного из атомов, что ведет к образованию отрицательно заряженного аниона. Чаще всего это атомы кислорода, азота или серы.
- Низкая электроотрицательность другого атома, что приводит к образованию положительно заряженного катиона. Чаще всего это атомы металлов, такие как натрий, калий или магний.
- Сильное притяжение между положительно заряженным катионом и отрицательно заряженным анионом.
- Образование кристаллической решетки, в которой ионы расположены в определенном порядке.
Определить наличие ионной связи можно с помощью различных методов, таких как:
- Анализ электроотрицательности атомов. Если разность в электроотрицательности атомов равна или превышает значение, указанное в таблице Полинга, то это свидетельствует о возможности образования ионной связи.
- Расчет электростатической энергии образования ионной связи. Если значение электростатической энергии отрицательное или близкое к нулю, то это говорит о стабильности ионной связи.
- Использование рентгеноструктурного анализа для определения расстояния между ионами в кристаллической решетке и их взаимного расположения.
Ионная связь играет важную роль в различных химических реакциях и влияет на свойства веществ. Понимание признаков и методов определения ионной связи позволяет более глубоко изучить химические процессы и использовать этот знак для прогнозирования свойств веществ.
Признаки ионной связи

Определение наличия ионной связи между атомами вещества может быть осуществлено на основании следующих признаков:
1. Ряд ионизационной энергии элементов: для образования ионной связи необходимо, чтобы один атом имел низкую ионизационную энергию (тенденцию отдавать электроны), а другой атом имел высокую ионизационную энергию (тенденцию принимать электроны).
2. Электроотрицательность элементов: в ионных соединениях наличие ионной связи зависит от разницы электроотрицательностей атомов. Чем больше эта разница, тем сильнее ионная связь.
3. Размеры ионых радиусов: ионная связь существует между ионами, имеющими разные размеры. Чем больше разница в размерах ионов, тем сильнее ионная связь.
4. Образование кристаллической решетки: при наличии ионной связи вещество образует кристаллическую решетку, в которой ионы располагаются в определенном порядке.
5. Свойства соединения: ионные соединения обладают характерными свойствами, такими как высокая температура плавления и кипения, хорошая проводимость электричества в расплавленном и растворенном состоянии, хрупкость и т.д.
Электроотрицательность атомов
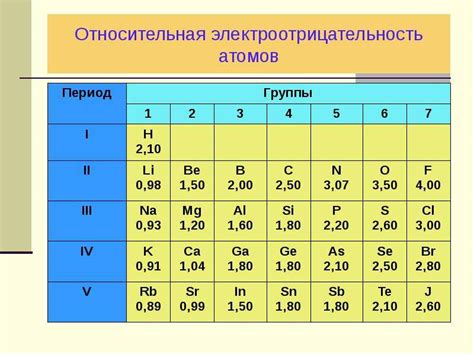
Таблица электроотрицательности Мюллера-Мессбауэра облегчает определение электроотрицательности атомов. В этой таблице каждому элементу соответствует числовое значение электроотрицательности. Чем больше значение, тем электроотрицательнее элемент.
| Элемент | Электроотрицательность |
|---|---|
| Водород (H) | 2.20 |
| Литий (Li) | 0.98 |
| Кислород (O) | 3.44 |
| Фтор (F) | 3.98 |
| Углерод (C) | 2.55 |
Разница в электроотрицательности между атомами имеет важное значение при определении типа связи между ними. Если разница в электроотрицательности больше 1,7, то это указывает на наличие ионной связи. Если же разница в электроотрицательности меньше 1,7, то это может указывать на наличие полярной ковалентной связи.
Электроотрицательность атомов важный фактор, который определяет тип химической связи между атомами. Понимание электроотрицательности помогает в изучении и понимании различных химических реакций и свойств веществ.
Формирование ионной связи
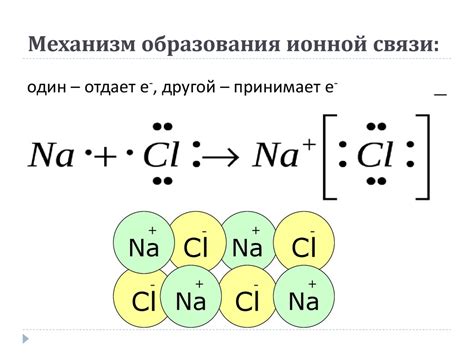
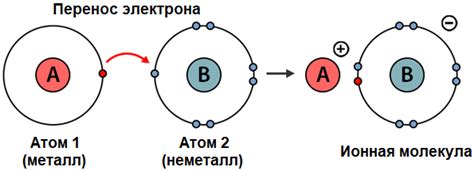
Формирование ионной связи происходит в результате разности электроотрицательностей атомов. Атомы с большей электроотрицательностью имеют большую тенденцию принимать электроны, становясь отрицательно заряженными ионами (анионами), тогда как атомы с меньшей электроотрицательностью имеют большую тенденцию отдавать электроны, становясь положительно заряженными ионами (катионами).
Процесс формирования ионной связи происходит следующим образом:
- Атомы с разной электроотрицательностью соединяются.
- Атом с более высокой электроотрицательностью принимает один или несколько электронов от атома с более низкой электроотрицательностью.
- Атомы становятся заряженными ионами с противоположными зарядами.
- Образованные ионы притягиваются друг к другу под действием электростатических сил, образуя ионную связь.
Примерами веществ, образующих ионную связь, являются соли, такие как хлорид натрия (NaCl) и сульфид кальция (CaS).
Методы определения наличия ионной связи
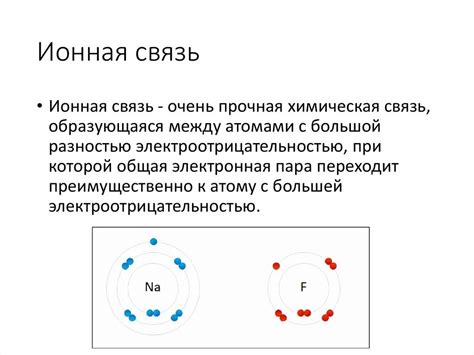
Метод обмена парными ионами (кристаллографические данные)
Один из наиболее надежных и точных методов определения наличия ионной связи между атомами - это анализ кристаллической структуры соединения.
Кристаллографические данные позволяют исследовать пространственное расположение атомов и их электронную структуру в кристаллической решетке. Установление расстояний между атомами и их координационного окружения является ключевым фактором для определения типа связи.
Метод спектроскопии ионных связей
Спектроскопические методы, такие как инфракрасная и УФ-видимая спектроскопия, также могут быть использованы для определения наличия ионной связи. Ионы обладают свойством поглощать или излучать электромагнитное излучение при переходе между энергетическими уровнями.
Анализ спектров поглощения или испускания излучения может указать на наличие ионной связи между атомами.
Метод рассмотрения электроотрицательности
Электроотрицательность атома является важным показателем возможности ионной связи. Если разность электроотрицательностей двух атомов составляет более 2, то с большой вероятностью между ними возникает ионная связь.
Таблицы электроотрицательностей атомов могут быть использованы для определения наличия ионной связи.
Метод расчета заряда атомов
Метод расчета заряда атомов в рассматриваемой молекуле может также помочь в определении наличия ионной связи. Расчеты производятся на основе квантово-химических методов, которые позволяют оценить заряды атомов в соединении.
Если заряды атомов существенно отличаются от нуля, то это может указывать на наличие ионной связи между атомами в молекуле.
Эти методы помогают установить наличие ионной связи между атомами и являются важным инструментом для изучения химических соединений.
Рентгеноструктурный анализ
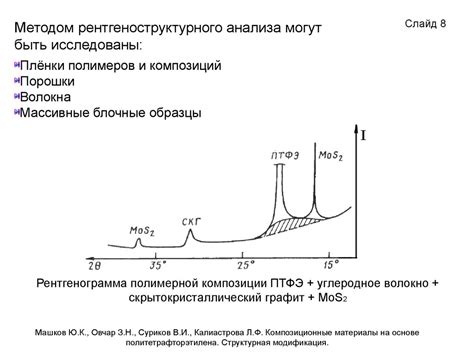
В основе рентгеноструктурного анализа лежит явление дифракции рентгеновских лучей. При прохождении рентгеновских лучей через кристалл, они дифрагируют, взаимодействуя с атомами вещества. Результатом этого взаимодействия является возникновение дифракционной картины - набора отраженных и прошедших лучей разной интенсивности и направления.
С помощью специального рентгеновского аппарата и детектора регистрируются углы, под которыми отражаются лучи от атомов кристалла. Далее, с использованием математического аппарата и специального программного обеспечения, анализируются полученные данные и определяются координаты атомов в кристаллической решетке.
Рентгеноструктурный анализ позволяет не только определить наличие ионной связи между атомами, но и изучить химическую структуру кристалла, его симметрию и особенности взаимодействия атомов. Этот метод является одним из основных инструментов современной кристаллографии и науки о материалах.
Спектроскопия
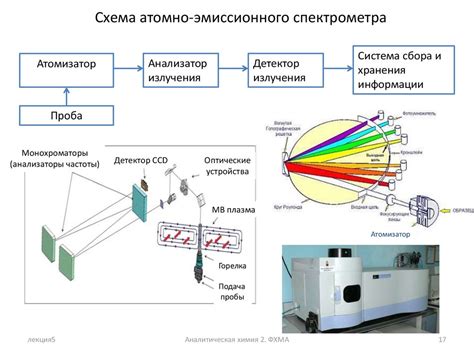
Основное применение спектроскопии в химии связано с изучением ионной связи между атомами. Эта связь возникает в результате перераспределения электронов между атомами, что ведет к образованию ионов с отрицательным и положительным зарядом. Явление ионной связи является одной из основных причин стабильности многих неорганических соединений.
Спектроскопические методы позволяют наблюдать и анализировать взаимодействие света с атомами, молекулами и ионами. Это может происходить как в видимом, так и в инфракрасном, ультрафиолетовом или рентгеновском диапазонах. Результаты спектрального анализа позволяют исследователям определить тип связи между атомами – координатную, ионную или ковалентную.
В спектроскопии применяются различные методы, включая атомную абсорбционную и флуоресцентную спектроскопию, масс-спектрометрию, ядерный магнитный резонанс и рентгеновскую спектроскопию, среди прочих. Каждый из этих методов имеет свои особенности и применяется для специфических типов исследований.
Использование спектроскопических методов в химии и физике позволяет нам более глубоко понять механизмы химических реакций, исследовать качество материалов, определить присутствие загрязнений или ионов в растворах, а также изучать фотокаталитические процессы и обнаруживать новые вещества.
Сравнительный анализ с химической связью
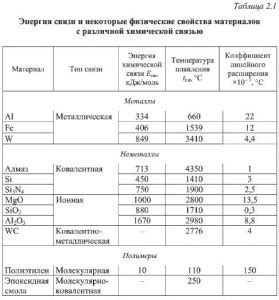
| Тип связи | Описание | Критерии |
|---|---|---|
| Ионная связь | Возникает между ионами с противоположными зарядами |
|
| Ковалентная связь | Возникает за счет общего использования электронов |
|
| Металлическая связь | Возникает между металлическими атомами, образуя сеть положительных ионов |
|
Сравнительный анализ позволяет увидеть особенности каждого вида химической связи и их различия. Ионная связь характеризуется образованием кристаллической структуры и хорошей проводимостью электричества. Ковалентная связь предполагает общее использование электронов, а металлическая связь - образование сети положительных ионов. В зависимости от типа связи, химические соединения могут иметь различные физические и химические свойства.