Периоды в химии – это основой организации элементов в таблицу Менделеева. Каждый элемент, который мы видим в таблице, находится в своем периоде, который определяется количеством электронных оболочек в его атоме. Периоды помогают систематизировать и классифицировать элементы в зависимости от их свойств и химической активности.
Как же найти периоды в химии? Все дело в строении атома. Атом состоит из ядра и электронной оболочки. Электронная оболочка состоит из электронных уровней или оболочек, каждый из которых может содержать определенное количество электронов.
Первый период в таблице Менделеева состоит только из двух элементов – водорода и гелия. Они содержат всего одну электронную оболочку. Второй период состоит из восьми элементов – лития, бериллия, бора, углерода, азота, кислорода, фтора и неона. Они имеют две электронные оболочки. Третий период уже имеет восемь элементов, с тремя электронными оболочками, и так далее.
Зачем нужно находить периоды в химии
Периоды в химии играют важную роль в классификации элементов и понимании их химических свойств. Они помогают организовать химические элементы в упорядоченную систему и обнаружить закономерности в их химическом поведении.
Периоды в таблице Менделеева представляют собой горизонтальные строки, в которых элементы располагаются в порядке возрастания атомного номера. Каждый период содержит новый энергетический уровень, что отражается на электронной конфигурации элементов.
Исследование периодов в химии позволяет установить сходства и различия между элементами и предсказать их свойства. Например, элементы одного периода обладают похожим химическим поведением, поскольку они имеют одинаковое количество энергетических уровней и электронов внешней оболочки.
Также периоды в химии помогают определить тренды в периодической системе элементов. Например, по мере увеличения атомного номера внутри одного периода, атомный радиус обычно уменьшается, а электроотрицательность увеличивается. Понимание этих трендов позволяет вычислять и прогнозировать свойства и реактивность элементов.
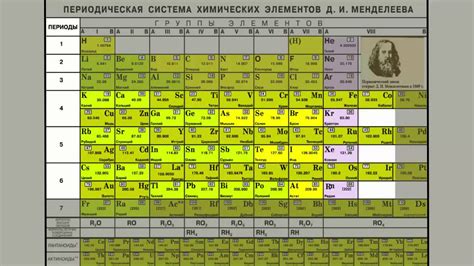
Периодическая система химических элементов
Она основана на упорядочении элементов по возрастанию атомного числа, атомной массе и химическим свойствам.
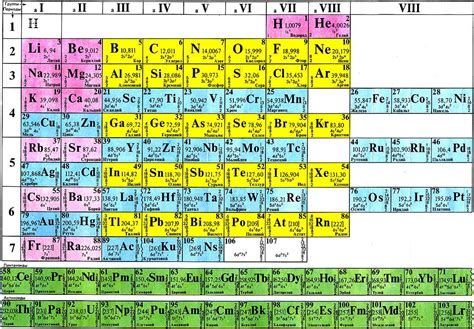
Периодическая система состоит из таблицы, в которой элементы располагаются в порядке возрастания атомного номера. В одной горизонтали таблицы располагается один период, а в одной вертикали располагается одна группа.
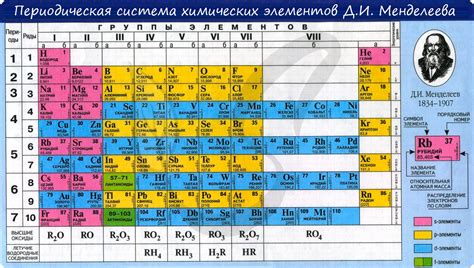
Горизонтали таблицы называются периодами, а вертикали - группами. Всего в таблице существует 7 периодов и 18 групп.
Каждый элемент таблицы содержит информацию об атомном номере, атомной массе, химическом символе и химическом названии элемента.
Расположение элементов в периодической системе позволяет устанавливать закономерности и связи между химическими элементами.
Вертикальные группы имеют схожие химические свойства, а элементы одной группы называются гомологами.
Периодическая система является необходимым инструментом для изучения химии, помогает систематизировать знания о химических элементах и понять их свойства и закономерности.
| Период | Группа | Название |
|---|---|---|
| 1 | 1 | Водород |
| 1 | 18 | Гелий |
| 2 | 1 | Литий |
| 2 | 2 | Бериллий |
История и развитие Периодической системы
Первым ученым, который предложил подход к классификации элементов, был немецкий химик Йоганн Вольфганг Дёберейнер. В 1817 году он разработал трехколонную таблицу, в которой элементы располагались в порядке возрастания их атомных масс. Однако, эта система имела недостатки и была отвергнута.
В 1869 году российский химик Дмитрий Иванович Менделеев предложил свою версию Периодической системы, которая была основана на классификации элементов по их атомным массам и химическим свойствам. Менделеев уверенно предсказал существование еще не открытых на тот момент элементов и предложил для них временные имена и свойства.
В последующие годы и десятилетия Периодическая система была постепенно доработана и улучшена на основе новых данных и открытий. Одним из крупных событий в развитии системы было открытие радия Марией и Пьером Кюри в 1898 году, которое подтвердило предсказания Менделеева по поводу некоторых неизвестных элементов и способствовало еще широкому признанию Периодической системы.
В настоящее время Периодическая система химических элементов имеет 118 элементов, включая искусственные элементы. Она является основой для понимания и изучения химических закономерностей и играет важную роль в науке и промышленности.
Функции периодов в химии
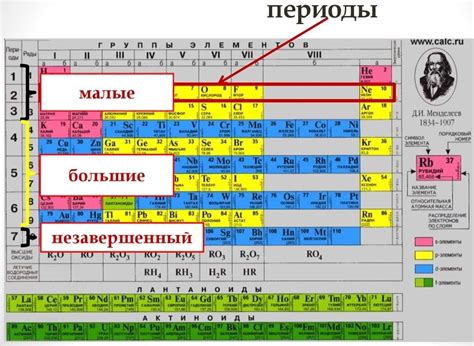
Периоды в химии представляют собой строки элементов в таблице Менделеева. Всего в таблице 7 периодов, каждый из которых имеет свои особенности и функции.
1. Определение химических свойств элементов
Периоды позволяют классифицировать элементы по их химическим свойствам. Внутри каждого периода элементы имеют схожие химические свойства, что обуславливается расположением этих элементов в одной строке.
2. Предсказание химических свойств новых элементов
Благодаря упорядоченности элементов в таблице Менделеева, периоды позволяют предсказать химические свойства новых элементов. Например, если определенный элемент находится в одной группе с другим элементом, известным по своим химическим свойствам, можно предположить, что новый элемент будет иметь схожие свойства.
3. Определение электронной конфигурации элементов
Количество электронов в атоме определяется его положением в периоде, а также в группе. Это позволяет определить электронную конфигурацию элементов и легко понять, какие орбитали заняты электронами.
4. Понимание трендов в свойствах элементов
Почему важно определять периоды в химических реакциях
Важность определения периодов в химических реакциях заключается, прежде всего, в возможности построения кинетических моделей и предсказании поведения веществ в процессе реакции. Опираясь на данные об изменении концентрации реагентов и образования продуктов с течением времени, можно вывести уравнения реакций, описывающие скорости протекания процессов.
Определение периодов также позволяет выявить особенности реакции и ее механизм. Реакции могут протекать в несколько стадий, и знание продолжительности каждой стадии позволяет понять, какие именно шаги являются рейтогенными и насколько они замедляют общую скорость реакции. Эта информация позволяет управлять реакцией, контролировать скорость или стабилизировать процесс, например, путем добавления ингибиторов или катализаторов.
Определение периодов важно также в практической химии, в частности, для производства химических веществ. Зная длительность каждого периода и условия, которые ему соответствуют, можно оптимизировать технологические процессы и повысить эффективность производства. Например, ускорить процессы, затратив меньше времени и ресурсов, или, наоборот, замедлить процессы, чтобы получить продукт более высокого качества.
| Преимущества определения периодов в химических реакциях: |
|---|
| 1. Построение кинетических моделей реакций. |
| 2. Предсказание поведения веществ в реакции. |
| 3. Выявление особенностей реакции и ее механизма. |
| 4. Управление реакцией, контроль скорости, стабилизация. |
| 5. Оптимизация технологических процессов в производстве. |
Способы нахождения периодов

Также для определения периодов в химии используется химическое поведение элементов. Элементы одного периода имеют схожие свойства и химические реакции. Например, элементы второго периода характеризуются тем, что они образуют соединения с химической формулой MX2.
Помимо этих методов, периоды в химии могут быть найдены с помощью рентгеноструктурного анализа. Этот метод позволяет определить строение кристаллической решетки вещества и выявить закономерности в расположении атомов, что помогает определить их принадлежность к определенному периоду.
Знание периодов в химии позволяет понять свойства элементов, их взаимодействие, а также предсказать и объяснить химические реакции и образование соединений. Поэтому выявление периодов является одной из важных задач в химии.
Как использовать электронную конфигурацию для определения периодов
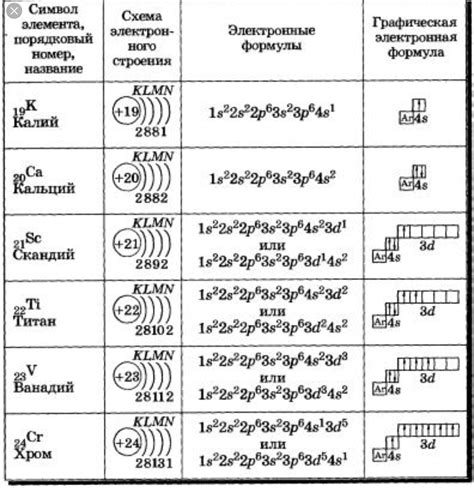
Электронная конфигурация атома химического элемента представляет собой упорядоченное распределение его электронов по энергетическим уровням и подуровням. Зная электронную конфигурацию атома, можно определить его место в периодической системе химических элементов.
Период в периодической системе определяется количеством энергетических уровней, на которых расположены электроны атома. Каждый новый энергетический уровень соответствует новому периоду. Например, если электронная конфигурация атома имеет один энергетический уровень, то данный атом находится в первом периоде периодической системы.
Количество электронов, расположенных на каждом энергетическом уровне, определяется электронной формулой атома. Зная электронную формулу, можно определить, сколько периодов находятся в атоме. Например, если атом имеет электронную формулу 2-8-1, то он имеет три периода, так как у него расположены электроны на трех энергетических уровнях.
Таким образом, электронная конфигурация атома позволяет определить его период в периодической системе химических элементов. Зная период, можно оценить основные свойства атома, такие как радиус, электроотрицательность и химическую активность.
Методы экспериментального определения периодов
Существует несколько методов, позволяющих экспериментально определить периоды в химии. Рассмотрим некоторые из них.
Метод масс-спектрометрии позволяет получить информацию о массе и составе молекул. С его помощью можно исследовать периоды разложения химических соединений и определить их воздействие на окружающую среду.
Метод ультрафиолетовой и видимой спектроскопии широко используется в определении периодов химических реакций. Путем измерения поглощения или рассеяния света можно получить информацию о скорости и характере реакции.
Метод теплового анализа позволяет изучать процессы фазовых переходов, распада или синтеза веществ. Путем измерения теплового эффекта при определенной температуре можно определить периоды химических реакций.
Важно отметить, что каждый из методов имеет свои преимущества и ограничения, поэтому их применение зависит от конкретной задачи и исследуемого вещества.
Примеры нахождения периодов в химии
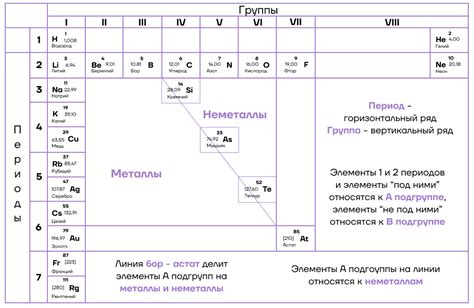
Периодическая таблица Менделеева
Основной инструмент для определения периодов и групп элементов в химии - это периодическая таблица Менделеева. Эта таблица представляет собой упорядоченный по возрастанию атомных номеров набор элементов.
Периоды в периодической таблице представлены горизонтальными строками, которые указывают на количество энергетических уровней у атомов элементов в данном периоде. Каждый новый период начинается с наличия нового энергетического уровня.
Пример
Рассмотрим пример нахождения периодов на основе периодической таблицы Менделеева. Возьмем элемент водород (H) с атомным номером 1. Изучив таблицу, мы видим, что водород находится в первом периоде. Как мы знаем, атомы водорода имеют только один энергетический уровень.
Возьмем другой элемент, например, углерод (C) с атомным номером 6. Изучив таблицу, мы видим, что углерод находится во втором периоде. Это означает, что атомы углерода имеют два энергетических уровня.
Нахождение периодов в химии осуществляется на основе периодической таблицы Менделеева. Каждый период представляет собой горизонтальную строку, указывающую на количество энергетических уровней у атомов элементов в данном периоде. Примеры, такие как водород и углерод, помогают наглядно представить, как находить периоды для других элементов.