Растворимость химических веществ является одним из ключевых параметров, влияющих на их реакционную способность и применение. Один из способов определить растворимость вещества – это использование электродвижущей силы (ЭДС). Этот метод позволяет рассчитать произведение растворимости, которое является критерием растворимости вещества в данной среде.
Произведение растворимости определяется с использованием электрохимической ячейки, состоящей из двух полуэлементов, разделенных мембраной. В каждом полуэлементе находится электрод и реагент, образующий соединение с переменной концентрацией вещества. Анализируя разность потенциалов между этими электродами, можно вычислить ЭДС, которая пропорциональна произведению растворимости.
Для расчета произведения растворимости следует измерить ЭДС с помощью вольтметра и провести необходимые математические операции. Важно учесть, что результаты могут зависеть от температуры, давления и других факторов, поэтому необходимо проводить измерения при заданных условиях и учитывать их в расчетах.
Как вычислить произведение растворимости через ЭДС

Для вычисления произведения растворимости через ЭДС необходимо произвести измерения ЭДС растворов различных концентраций и использовать их значения для построения графика. Далее следует использовать полученную зависимость для определения Ksp.
Процесс вычисления произведения растворимости через ЭДС можно разбить на следующие шаги:
- Подготовьте растворы различных концентраций ионов вещества, для которого вы хотите определить Ksp.
- Измерьте ЭДС для каждого раствора при помощи ионного селективного электрода.
- Постройте график зависимости ЭДС от концентрации ионов.
- Используйте полученную зависимость для определения Ksp, который будет равен квадрату произведения концентраций ионов в насыщенном растворе.
Важно отметить, что для достоверных результатов необходимо провести несколько измерений и усреднить полученные значения ЭДС. Также нужно помнить, что метод определения Ksp через ЭДС может быть применен только для растворимых соединений.
| Концентрация ионов (моль/л) | ЭДС (Вольт) |
|---|---|
| 0.001 | 0.2 |
| 0.005 | 0.4 |
| 0.01 | 0.6 |
| 0.05 | 0.8 |
Пример таблицы с результатами измерений ЭДС для различных концентраций ионов.
После построения графика и определения Ksp можно использовать полученные данные для дальнейших расчетов и прогнозирования растворимости ионов в данном веществе.
ЭДС и её связь с произведением растворимости
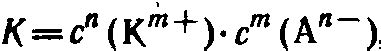
Произведение растворимости (Ksp) – это термодинамическая характеристика растворения химического вещества в растворе при насыщении. Оно показывает, насколько хорошо вещество растворяется в данном растворителе и является мерой его растворимости.
Существует связь между ЭДС и произведением растворимости. Для реакции растворения, в которой участвуют электроды, произведение растворимости можно выразить с использованием концентраций ионов, находящихся в растворе. ЭДС такой электрохимической системы можно выразить через потенциалы электродов и концентрации ионов.
Связь между ЭДС и произведением растворимости может быть выражена через уравнение Нернста:
E = E0 - (RT/nF) * ln(Q)
где:
- E – ЭДС электрохимической системы;
- E0 – стандартный потенциал электродной пары;
- R – универсальная газовая постоянная;
- T – температура;
- n – число электронов, передаваемых в реакции;
- F – постоянная Фарадея;
- Q – выражение, связанное с концентрациями ионов в растворе.
Это уравнение позволяет оценить связь между ЭДС и произведением растворимости, и, в частности, предсказать значения ЭДС для различных концентраций ионов в растворе. Таким образом, зная ЭДС электрохимической системы, можно оценить степень растворимости химического соединения и провести анализ его растворимости.
Примеры расчета произведения растворимости через ЭДС

Произведение растворимости (Кра) может быть рассчитано с использованием ЭДС (электродной разности потенциалов) при известных концентрациях ионов в растворе. Вот несколько примеров расчета произведения растворимости через ЭДС:
Рассмотрим реакцию:
A(s) <=> A+(aq) + e-
Предположим, что между металлическим электродом A и раствором A+ существует равноценная противоионная связь. Если измерить ЭДС между этими двумя электродами, то она будет связана с концентрацией ионов A+ по уравнению Нернста:
ЭДС = E0 - (RT / nF) * ln([A+])
где E0 - потенциал равновесия реакции, R - газовая постоянная, T - температура, n - количество электронов, F - постоянная Фарадея.
Используя измеренное значение ЭДС и зная все остальные переменные, можно рассчитать концентрацию ионов A+ и, следовательно, произведение растворимости.
Другой пример:
MnO2(s) + 4H+(aq) + 2e- <=> Mn2+(aq) + 2H2O(l)
В этой реакции происходит окисление MnO2 до Mn2+ и снижение концентрации H+ от 4 до 2. Если измерить ЭДС между металлическим электродом и раствором, содержащим MnO2 и H+, то можно рассчитать произведение растворимости MnO2.
Это лишь два примера использования ЭДС для расчета произведения растворимости. В зависимости от конкретной реакции и системы могут быть другие уравнения и методы расчета. Однако принцип остается общим - измерение ЭДС позволяет определить концентрацию ионов и рассчитать произведение растворимости.
Особенности применения ЭДС для определения произведения растворимости

Одной из особенностей применения ЭДС является его зависимость от концентрации ионов в растворе. Чем больше концентрация ионов, тем выше значение ЭДС. Таким образом, путем измерения ЭДС можно определить произведение растворимости.
Для использования ЭДС в определении произведения растворимости необходимо подготовить электроды и ионно-селективные электроды. Электроды должны быть чистыми и готовыми к использованию. Ионно-селективные электроды специально созданы для измерения концентрации определенного иона в растворе.
При проведении эксперимента, сначала подключаются рабочий и компенсационный электроды к внешней схеме, а затем вводят в раствор ионно-селективный электрод. Затем измеряется ЭДС между двумя электродами. Полученное значение ЭДС интерпретируется для определения произведения растворимости.
Важно отметить, что ЭДС метод не является универсальным и может быть применен только для определенных типов ионов. Кроме того, результаты могут быть влияние от других факторов, таких как температура и давление. Поэтому для получения точных и надежных результатов необходимо учитывать все эти факторы и проводить контрольные измерения.