Гибридизация атомов углерода - важная концепция в органической химии, которая позволяет определить строение и свойства органических соединений. Гибридизацию атома углерода можно определить на основе его связей и геометрии молекулы.
Обычно углеродные атомы образуют четыре σ-связи со смежными атомами, но иногда атом углерода может образовывать двойные или тройные связи. Гибридизация атома углерода может быть sp3, sp2 или sp в зависимости от количества и типа его σ-связей.
Гибридизация sp3 является наиболее распространенной и характерна для алканов и алкилов. В таком случае, атом углерода образует четыре σ-связи с другими атомами, и его электронные орбитали гибридизуются в sp3-орбитали. Эта гибридизация придает атому углерода тетраэдрическую геометрию.
Гибридизация sp2 наблюдается у алкенов, ароматических соединений и некоторых карбонильных соединений. В этом случае, атом углерода образует три σ-связи и одну π-связь, и его электронные орбитали гибридизуются в sp2-орбитали. Эта гибридизация придает атому углерода плоскую геометрию.
Гибридизация sp наблюдается у алкинов и некоторых других карбонильных соединений. В этом случае, атом углерода образует две σ-связи и две π-связи, и его электронные орбитали гибридизуются в sp-орбитали. Эта гибридизация придает атому углерода линейную геометрию.
Виды гибридизации атома углерода
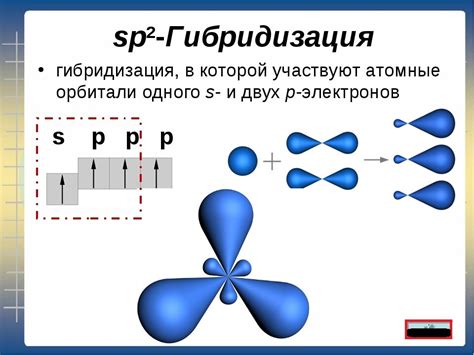
Гибридизация атома углерода описывает структурные особенности молекул органических соединений и играет ключевую роль в их химических свойствах. Атом углерода может проявлять различные виды гибридизации в зависимости от того, какие энергетические условия присутствуют в молекуле. Ниже приведены основные виды гибридизации атома углерода:
| Вид гибридизации | Описание | Примеры |
|---|---|---|
| sp3 | Атом углерода образует 4 равноотстоящих связи с другими атомами. Этот вид гибридизации характерен для насыщенных углеводородов (например, метан, этан). | CH4, C2H6, C3H8 |
| sp2 | Атом углерода образует 3 связи с другими атомами и имеет одну неподелённую π-электронную область. Этот вид гибридизации характерен для алкенов и ароматических соединений. | C2H4, C6H6 |
| sp | Атом углерода образует 2 связи с другими атомами и имеет две неподелённые π-электронные области. Этот вид гибридизации характерен для алкинов и ионов углерода в органических соединениях. | C2H2, C2H- |
Вид гибридизации атома углерода определяет его геометрическую структуру и углы между связями, а также влияет на его способность образовывать связи с другими атомами и участвовать в химических реакциях. Понимание видов гибридизации атома углерода позволяет разбираться в структуре и свойствах органических соединений и способствует более глубокому пониманию химической науки в целом.
Определение гибридизации атома углерода
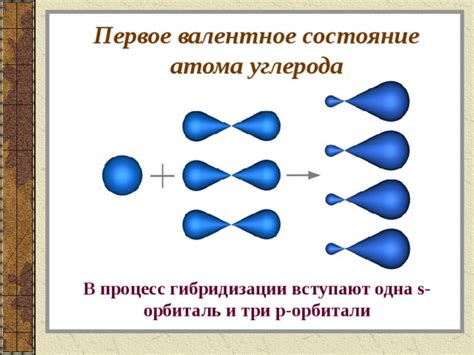
Существует несколько методов для определения гибридизации атома углерода:
| Метод | Описание |
|---|---|
| Метод цепного разложения | Путем последовательного проставления двойных и тройных связей между атомами углерода можно определить количество свободных электронных пар, а следовательно, и гибридизацию атома углерода. |
| Метод VSEPR | Валентностно-экспериментальная теория репульсионного взаимодействия электронных пар позволяет определить гибридизацию на основе геометрической структуры молекулы и количества электронных облаков вокруг атома углерода. |
| Метод поиска несвязанных электронных пар | Гибридизация можно определить также путем подсчета несвязанных электронных пар, что поможет определить количество гибридизированных орбиталей. |
Знание гибридизации атома углерода позволяет более глубоко изучить органическую химию и понять свойства и реакционную способность молекулы.
Экспертные советы по определению гибридизации атома углерода
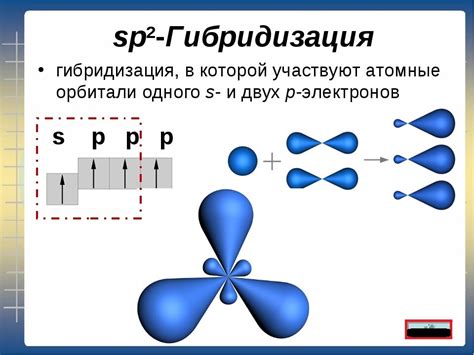
Существует несколько методов для определения гибридизации атома углерода:
- Наблюдение за числом заместителей: Гибридизация атома углерода зависит от числа его заместителей. Например, если углерод имеет четыре заместителя, то его гибридизация будет sp3, а если три заместителя - sp2, и так далее.
- Анализ углеводородной цепи: Изучение структуры углеводородной цепи также может помочь определить гибридизацию атома углерода. Например, если обнаружена двойная или тройная связь между атомами углерода, то их гибридизация будет sp2 или sp соответственно.
- Рассмотрение геометрии молекулы: Гибридизация атома углерода также может быть определена на основе геометрии молекулы. Например, если атом углерода имеет треугольную плоскую геометрию, это указывает на его sp2-гибридизацию.
- Использование спектральных методов: Спектральные методы, такие как ЯМР-спектроскопия и ИК-спектроскопия, могут также помочь определить гибридизацию атома углерода, исследуя смещения химических сигналов и характерные полосы поглощения.
Важно помнить, что определение гибридизации атома углерода требует некоторой практики и знания в области органической химии. Часто требуется комбинация нескольких методов для получения точного результата.
Используйте эти экспертные советы для определения гибридизации атома углерода в молекуле и повышения понимания органической химии.
Получение точного результата при определении гибридизации атома углерода
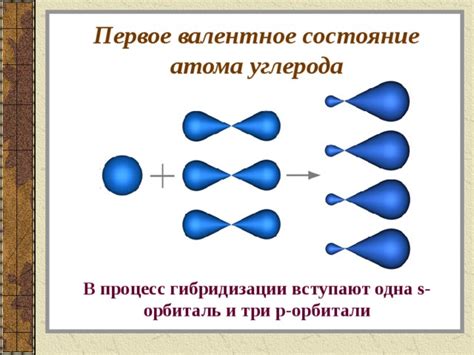
Вот несколько советов, которые помогут вам определить гибридизацию атома углерода с высокой точностью:
- Анализ окружающих атомов: Проследите, сколько и какие атомы связаны с атомом углерода. Обратите внимание на количество одиночных, двойных или тройных связей. Эти данные могут дать вам первичную информацию о гибридизации атома углерода.
- Расчет числа связей и einsatic energy: Используйте различные математические методы, такие как метод валентных связей или метод молекулярных орбиталей, для расчета числа связей и энергии связи. Эти данные помогут вам определить тип гибридизации.
- Спектроскопические методы: Используйте различные спектроскопические методы, такие как инфракрасная или ядерномагнитная резонансная спектроскопия, для анализа поведения атома углерода в молекуле. Эти методы позволяют определить тип гибридизации и связи атома углерода с другими атомами.
- Рассмотрение геометрии молекулы: Изучите геометрию молекулы и углы между связями. Важно знать, что различные типы гибридизации приводят к различной геометрии молекулы. Например, гибридизация sp3 приводит к тетраэдрической геометрии, а гибридизация sp2 – к плоской треугольной геометрии.
Соблюдение этих методов и подходов поможет вам получить точный результат при определении гибридизации атома углерода. Важно учитывать все доступные данные и проводить сравнение с известными структурами и свойствами молекул, чтобы исключить возможные ошибки или неточности.