Химическая связь - одно из основных понятий химии, изучение которого является неотъемлемой частью химического образования. Определение вида химической связи - это ключевой шаг при анализе и понимании структуры химических соединений и молекул. В этой статье мы рассмотрим основные методы определения типов связей и предоставим вам практическое руководство по их применению.
Первоначально, для понимания различных типов связей необходимо знать их определение. Два главных вида химических связей - это ионная связь и ковалентная связь. Ионная связь образуется между атомами, когда один из них отдает электроны другому, что приводит к образованию положительно и отрицательно заряженных ионов, притягивающихся друг к другу силами электростатического взаимодействия.
Ковалентная связь, с другой стороны, основана на общем использовании электронных пар атомами, чтобы достичь электронной устойчивости. В данной связи атомы делят свою общую пару электронов между собой, что позволяет им быть электронно устойчивыми. Однако, помимо этих двух основных видов, существуют и другие типы химических связей, такие как металлическая связь и водородная связь, которые играют важную роль в различных химических реакциях и структуре соединений.
Виды химической связи
1. Ионная связь - это связь, которая образуется между положительно и отрицательно заряженными ионами. Один атом отдает электрон(ы), становится положительно заряженным ионом (катионом), а другой атом принимает электрон(ы), становится отрицательно заряженным ионом (анионом). Примером ионной связи является связь в хлориде натрия (NaCl).
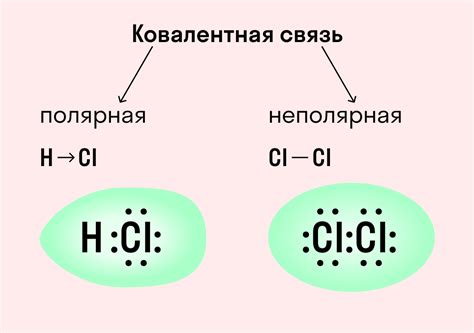
2. Ковалентная связь - это связь, которая образуется между двумя атомами, когда они делят электроны. Ковалентная связь может быть полярной или неполярной, в зависимости от разности электроотрицательности атомов. Примером ковалентной связи является связь между двумя атомами кислорода в молекуле кислорода (O2).
3. Металлическая связь - это связь, характерная для металлов. Металлы образуют кристаллическую решетку, в которой положительные ионы металла окружены «облаком» свободно движущихся электронов. Примером металлической связи является связь в меди (Cu).
4. Водородная связь - это слабая связь, которая образуется между молекулами, содержащими водород, привлекательными электронными облаками других молекул. Водородная связь играет важную роль в свойствах воды и биологических системах. Примеры водородной связи включают взаимодействие между молекулами воды (H2O) и молекулами ДНК.
Понимание различных видов химической связи позволяет улучшить наше понимание о строении и свойствах веществ, а также о реакциях, в которых они участвуют.
Ковалентная связь

Ковалентная связь представляет собой тип химической связи, при которой электроны, находящиеся на внешней оболочке атомов, образуют пары, общие для двух или более атомов. Таким образом, происходит обмен электронами и образование молекул.
Ключевыми особенностями ковалентной связи являются:
- Совместное использование электронов.
- Образование попарно связанных атомов.
- Образование молекулы.
Ковалентная связь может быть полярной или неполярной. Полярная ковалентная связь возникает при различной электроотрицательности атомов, что приводит к преобладанию одного из электронов и образованию полярного молекулярного диполя. Неполярная ковалентная связь возникает при одинаковой электроотрицательности атомов.
Ковалентная связь можно определить на схеме по характеристикам, таким как тип электронной оболочки атомов, валентность, длина и угол связи, а также способ образования связи между атомами.
Наличие ковалентной связи в молекуле обуславливает ее устойчивость, свойства и возможность участия в химических реакциях. Понимание ковалентной связи позволяет более глубоко изучать химическую структуру веществ и их взаимодействие.
Ионная связь

В ионной связи атом, отдающий электрон, становится положительным ионом, называемым катионом. В свою очередь, атом, принимающий электрон, становится отрицательно заряженным ионом, называемым анионом. Катионы и анионы образуют кристаллическую решётку, которая определяет их расположение и структуру вещества.
Примеры веществ, состоящих из ионной связи:
- Хлорид натрия (NaCl) - кристаллическое соединение, состоящее из Na+ и Cl- ионов.
- Оксид магния (MgO) - соединение, состоящее из Mg2+ и O2- ионов.
- Карбонат кальция (CaCO3) - содержит Ca2+, CO32- ионы.
Ионная связь обладает высокой прочностью, что делает вещества с такой связью твёрдыми и хрупкими при комнатной температуре. Она имеет важное значение в многих аспектах химии, включая образование солей, проведение электролиза и образование кристаллических структур.
Металлическая связь

Металлическая связь формируется благодаря наличию свободных электронов в зоне проводимости металла. В металлах внешние электроны слабо связаны с ядрами и могут свободно перемещаться по кристаллической решетке.
Электроны в металлической связи не принадлежат конкретным атомам, а представляют собой общую "электронную облако". Именно свободные электроны отвечают за теплопроводность и электропроводность металлов.
Металлическая связь обуславливает такие свойства металлов, как высокая пластичность и хорошая обработка давлением. Благодаря этой связи металлы могут легко изменять форму, не ломаясь.
Металлическая связь также отвечает за способность металлов образовывать сплавы. В сплавах атомы различных металлов образуют силу связи со свободными электронами, что позволяет им образовывать однородное вещество.
- Металлическая связь основана на перемещении электронов между атомами металла.
- Особенностью металлической связи является наличие свободных электронов в зоне проводимости металла.
- Электроны в металлической связи представляют собой общую "электронную облако".
- Металлическая связь обуславливает свойства металлов, такие как пластичность и хорошая обработка давлением.
- Способность металлов образовывать сплавы связана с металлической связью.
Водородная связь
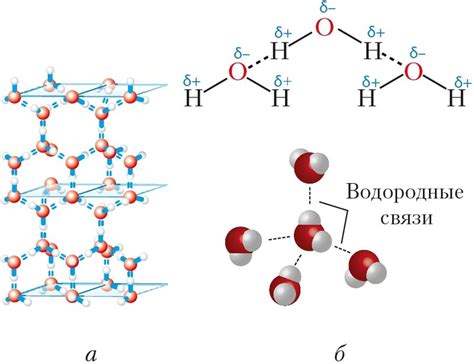
Водородные связи влияют на физические и химические свойства вещества. Они могут определять температуру кипения и плавления соединений, их растворимость и вязкость. Водородные связи играют важную роль в стабилизации структуры белков, ДНК и молекул воды.
Водородные связи также могут быть важными в протекании химических реакций. Их наличие или отсутствие может определять протекание реакции или изменение скорости реакции. Водородные связи особенно важны в растворах и в жидкой воде, что делает их ключевым понятием в области химии и биологии.