Электроны являются одной из основных частиц, составляющих атомы и молекулы. Они играют важную роль в химии и физике, и понимание их распределения в формулах является ключевым для понимания связей и химических реакций.
В этом полном руководстве для новичков мы рассмотрим, как найти и представить электроны в формулах. Мы изучим основные правила и принципы, которые помогут вам получить представление о том, сколько электронов содержится в каждом атоме и как они связаны друг с другом. Независимо от вашего уровня знаний, вы сможете освоить эту важную тему.
Если вы новичок в области химии или физики, не волнуйтесь. В этом руководстве мы начнем с основ, постепенно двигаясь к более сложным концепциям. В конце вы будете уверены в своих навыках и способны самостоятельно находить электроны в формулах и анализировать химические соединения.
Основы поиска электронов в формулах химических соединений
Чтобы найти электроны в формуле химического соединения, сначала нужно разобраться в структуре атомов, из которых оно состоит. Атомы состоят из ядра, которое содержит протоны и нейтроны, и облака электронов, которые обращаются вокруг ядра.
Расположение электронов вокруг ядра можно представить в виде электронных оболочек или орбиталей. Каждая оболочка или орбиталь имеет определенную энергию и может содержать определенное количество электронов.
Чтобы найти количество электронов в формуле химического соединения, нужно узнать количество электронов каждого атома, представленного в формуле. Обычно количество электронов в атоме равно его атомному номеру. Например, атом углерода имеет 6 электронов, а атом кислорода - 8 электронов.
Чтобы определить расположение электронов в молекуле, нужно учитывать их энергетический уровень и орбиталь. Электроны внешней оболочки атома, называемой валентной оболочкой, играют ключевую роль в химических реакциях и связывании атомов в молекулы.
Когда атомы соединяются, они обменивают, заимствуют или делят электроны, чтобы достичь стабильной конфигурации электронов. Это основа химической связи - совместное использование или обмен электронами для достижения электронной стабильности.
Поисковые электроны в формулах химических соединений может быть сложно для начинающих, но с практикой и пониманием основных принципов можно развить навык визуализации и анализа электронных конфигураций атомов и молекул.
Как определить количество электронов в атоме
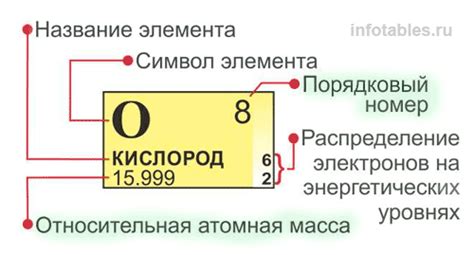
Количество электронов в атоме можно определить с помощью периодической таблицы элементов. Каждый элемент имеет свой атомный номер, который соответствует количеству электронов в атоме. Атомный номер прописывается над символом элемента в периодической таблице.
Если электронная конфигурация элемента неизвестна, можно использовать различные правила и закономерности, чтобы приближенно определить количество электронов. Ниже приведены некоторые из них:
- Для элементов в одной группе (вертикальный столбец в периодической таблице), количество внешних электронов (электронов в самой внешней энергетической оболочке) обычно равно номеру группы.
- Для переходных элементов количество электронов внешней оболочки может быть различным и лучше определить по атомному номеру.
- Для элементов в одном периоде (горизонтальный ряд в периодической таблице) количество электронов внешней оболочки увеличивается по мере движения слева направо.
- Не забудь учесть ионы, которые могут иметь разное количество электронов в сравнении с нейтральным атомом элемента.
При работе с более сложными молекулами или соединениями, определение количества электронов может стать сложнее и потребовать более глубокого понимания электронной структуры атомов.
Надеюсь, эта информация поможет вам определить количество электронов в атоме и лучше понять структуру элементов в периодической таблице.
Как найти количество электронов в молекуле

Количество электронов в молекуле определяется суммой всех электронов, принадлежащих атомам, образующим молекулу. Чтобы найти это число, необходимо знать структуру молекулы и количество атомов каждого элемента в ней.
Существуют несколько методов для определения числа электронов в молекуле. Один из них - использование формульного веса молекулы и зарядности ионов, если таковые имеются.
- Начните с записи формулы молекулы, указав количество каждого атома. Например, для молекулы воды (H2O) есть 2 атома водорода (H) и 1 атом кислорода (O).
- Узнайте атомные номера для каждого элемента: 1 для водорода и 8 для кислорода.
- Найдите количество электронов в каждом атоме, используя его атомный номер. Например, водород (H) имеет 1 электрон, а кислород (O) - 8 электронов.
- Умножьте количество атомов каждого элемента на количество электронов в каждом атоме и сложите полученные произведения. В случае воды: (2 * 1) + (1 * 8) = 2 + 8 = 10 электронов.
Таким образом, в молекуле воды содержится 10 электронов. Этот метод можно применять для любой молекулы, зная ее состав и атомные номера соответствующих элементов.
Правила заполнения электронных оболочек
Электронные оболочки атома представляют собой орбитали, на которых находятся электроны. Для правильного заполнения оболочек существуют определенные правила, которые должны соблюдаться:
| Номер оболочки | Максимальное количество электронов |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 8 |
| 4 | 18 |
| 5 | 18 |
| 6 | 32 |
| 7 | 32 |
Полнота оболочек определяется по основанию двоичной системы. Каждому электроносодержащему элементу соответствует уникальное число электронов в оболочке. Например, вторая оболочка будет полностью заполнена, если в ней находится 8 электронов. Также важно отметить, что первая оболочка (K-оболочка) заполняется в первую очередь, затем вторая оболочка (L-оболочка) и так далее.
Иногда нарушается правило заполнения оболочек, например, при ионизации атома или образовании химической связи. В таких случаях электроны могут перемещаться с одной оболочки на другую.
Теперь, зная правила заполнения электронных оболочек, вы можете легко определить количество электронов в каждой оболочке элемента и использовать эту информацию для дальнейшего изучения химии.
Примеры поиска электронов в формулах сложных соединений
Поиск электронов в формулах сложных соединений может быть вызовом для новичков. Однако, с некоторой практикой и пониманием основных принципов, можно стать более уверенным в этом процессе. В этом разделе мы рассмотрим несколько примеров поиска электронов в формулах сложных соединений.
Пример 1: Взглянем на молекулу воды (H2O). Вода состоит из двух атомов водорода (H) и одного атома кислорода (O). Каждый атом водорода имеет один электрон, в то время как атом кислорода имеет восемь электронов. Это представлено следующей таблицей:
| Атомы | Электроны |
|---|---|
| Водород (H) | 1 электрон |
| Кислород (O) | 8 электронов |
Пример 2: Рассмотрим молекулу диоксида углерода (CO2). В этом случае у нас два атома кислорода (O) и один атом углерода (C). Каждый атом кислорода имеет восемь электронов, а атом углерода также имеет восемь электронов. Всего в молекуле CO2 находим 24 электрона, что представлено следующей таблицей:
| Атомы | Электроны |
|---|---|
| Углерод (C) | 8 электронов |
| Кислород (O) | 16 электронов |
Пример 3: Теперь рассмотрим еще одну сложную молекулу - ацетата метила (CH3COOCH3). Эта молекула содержит атомы углерода (C), водорода (H) и кислорода (O). Атом углерода (C) имеет четыре электрона, каждый атом водорода (H) - один электрон, а атомы кислорода (O) - восемь электронов. Общее количество электронов в молекуле CH3COOCH3 равно 24, что представлено следующей таблицей:
| Атомы | Электроны |
|---|---|
| Углерод (C) | 4 электрона |
| Водород (H) | 4 электрона |
| Кислород (O) | 16 электронов |
Это лишь несколько примеров поиска электронов в формулах сложных соединений. Важно помнить, что количество электронов в молекуле определяется суммарным числом электронов, присутствующих в атомах, и может зависеть от их валентности и степени окисления.