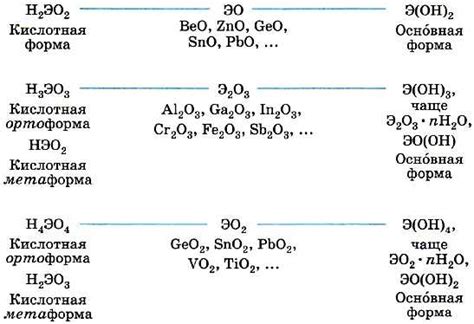
Амфотерные оксиды и гидроксиды – это вещества, которые могут проявлять свойства и оснований, и кислот. Они имеют способность взаимодействовать с кислотами и щелочами, демонстрируя различные свойства в зависимости от окружающей среды. Если вы сталкиваетесь с определением таких веществ, важно знать, на что обратить внимание и какие методы использовать.
Один из методов определения амфотерных оксидов и гидроксидов состоит в исследовании их реакций с различными растворами. Если вещество растворимо в воде и за кислую среду превращается в соль, а за щелочную - в воду и соль, то это может указывать на его амфотерность. Например, оксид алюминия (Al2O3) при растворении в соляной кислоте даёт соль алюминия, а в щелочи (например, гидроксид натрия) - воду и соль.
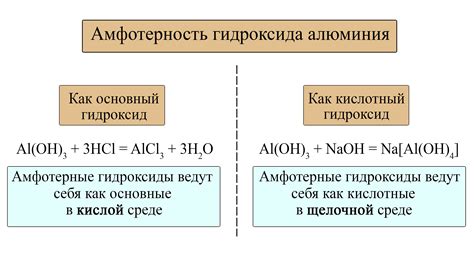
Другим признаком амфотерных оксидов и гидроксидов может быть их способность взаимодействовать с лугами и кислотами с выделением газа. Например, гидроксид алюминия (Al(OH)3) при реакции с соляной кислотой выделяет газ, а при реакции с натриевой гидроксидом наблюдается появление пузырьков газа.
Определение амфотерного оксида и гидроксида: 7 полезных советов и рекомендаций

Вот 7 полезных советов и рекомендаций для определения амфотерных оксидов и гидроксидов:
| 1. | Изучите таблицы реакций оксидов и гидроксидов для определения их свойств. Эти таблицы содержат информацию о реагентах и условиях, при которых оксид или гидроксид выражает кислотные или основные свойства. |
| 2. | Проанализируйте pH-значения раствора вещества. Если pH значительно меньше 7, то вещество является кислотным; если значительно больше 7, то оно является щелочным; если pH примерно равно 7, то имеется дело с нейтральным веществом. |
| 3. | Проведите эксперименты с различными реагентами. Наблюдайте изменение цвета, образование пузырей или выделение газов при взаимодействии оксида или гидроксида с кислотой или основанием. |
| 4. | Изучите свойства оксида или гидроксида в зависимости от реакции с металлом или неметаллом. Некоторые амфотерные соединения могут выделять газы или образовывать осадки при взаимодействии с различными типами элементов. |
| 5. | Обратите внимание на изменение ph-значения раствора оксида или гидроксида при добавлении кислоты или основания. Если значение становится близким к 7, то вещество является амфотерным. |
| 6. | Проведите испытания с различными растворителями. Некоторые оксиды и гидроксиды могут проявлять кислотные или основные свойства только в определенных растворителях, в то время как в других они могут быть нейтральными. |
| 7. | Примените индикаторы pH для определения характера реагента. Индикаторы изменяют цвет в зависимости от кислотности, щелочности или нейтральности раствора. |
Следуя данным советам, вы сможете определить, является ли вещество амфотерным оксидом или гидроксидом. Это знание сыграет важную роль в понимании химических реакций и их применении в практике.
Разница между оксидами и гидроксидами

Оксиды - это химические соединения, состоящие из кислорода и другого элемента. Они обычно обладают высокой степенью реактивности и являются окислителями или изменяют степень окисления других элементов.
Гидроксиды, или основания, состоят из гидроксильной группы (OH-) и катионного иона. Они обладают щелочными свойствами и могут реагировать с кислотами, образуя соль и воду.
Основная разница между оксидами и гидроксидами:
- Состав: оксиды состоят из кислорода и другого элемента, в то время как гидроксиды содержат гидроксильную группу (OH-) и ионный элемент.
- Свойства: оксиды часто обладают окислительными свойствами, в то время как гидроксиды обладают щелочными свойствами.
- Реакции: оксиды могут реагировать с другими веществами, изменяя их степень окисления, в то время как гидроксиды могут реагировать с кислотами, образуя соль и воду.
- Наименование: оксиды обычно именуются по имени элемента и словом "оксид", в то время как гидроксиды имеют окончание "-ид" в имени и начинаются с названия катионного иона.
Таким образом, различие между оксидами и гидроксидами заключается в их составе, свойствах, реакциях и наименовании. Понимание этих различий поможет определить, какой тип соединения имеется перед нами и какие свойства и реакции можно ожидать от него.
Основные свойства амфотерных соединений
Одним из примеров амфотерных соединений является вода. Вода может проявлять кислотные свойства, отдавая протон, а также щелочные свойства, принимая протон. Это объясняется наличием ионов гидроксида (OH-) в реакции с сильной кислотой и ионов гидрония (H3O+) в реакции с сильной щелочью.
Другим примером амфотерного соединения является оксид алюминия (Al2O3). Он может взаимодействовать и с кислотами, и с щелочами, образуя соли и различные соединения. Это свойство делает оксид алюминия эффективным обеззараживающим и антиоксидантным агентом.
Амфотерные соединения имеют широкий спектр применения. Они используются в различных областях, включая химическую промышленность, медицину, косметологию и строительство. Знание основных свойств амфотерных соединений позволяет определить их реакционную способность и использовать их по назначению.
Химические реакции с амфотерными оксидами

Амфотерные оксиды обладают способностью реагировать как с кислотами, так и с щелочами, что отличает их от других оксидов. Реакции с амфотерными оксидами могут быть различными и могут привести к образованию разных продуктов в зависимости от условий.
Одним из обычных способов взаимодействия амфотерных оксидов является их реакция с кислотами. В таком случае амфотерный оксид действует как основание, принимая протон от кислоты. Например, оксид алюминия (Al2O3) реагирует с кислотой с образованием соли:
- Al2O3 + 6HCl → 2AlCl3 + 3H2O
Амфотерные оксиды также могут реагировать с щелочами. В этом случае оксид действует как кислотное соединение, отдающее протон щелочи. Например, оксид цинка (ZnO) реагирует с щелочью с образованием соли:
- ZnO + 2NaOH → Na2ZnO2 + H2O
Реакции с амфотерными оксидами также могут приводить к образованию гидроксидов. Например, оксид бора (B2O3) реагирует с водой, образуя гидроксид бора:
- B2O3 + 3H2O → 2H3BO3
Общими чертами химических реакций с амфотерными оксидами являются их способность работать как кислотные и основные вещества в различных условиях. Это делает амфотерные оксиды важными соединениями в различных отраслях науки и промышленности.
Идентификация амфотерных гидроксидов
Для идентификации амфотерных гидроксидов можно использовать следующие методы:
| Метод | Описание |
|---|---|
| Реакция с кислотами | Амфотерные гидроксиды реагируют с кислотами, образуя соли и воду. Это можно проверить, добавив немного кислоты к образцу гидроксида и наблюдая, происходит ли образование соли. |
| Реакция с щелочами | Амфотерные гидроксиды также могут реагировать с щелочами, образуя соли и воду. Для проверки этой реакции нужно добавить немного щелочи к образцу гидроксида и наблюдать, происходит ли образование соли. |
| Реакция с индикаторами | Амфотерные гидроксиды могут показывать различные цветные изменения при взаимодействии с индикаторами. Это можно использовать для определения их амфотерности. Так, например, при добавлении фенолфталеина к щелочному раствору амфотерного гидроксида, он приобретает розовую окраску, а при добавлении кислоты - становится безцветным. |
Используя эти методы, можно определить, является ли вещество амфотерным гидроксидом или нет. Идентификация амфотерных гидроксидов позволяет понять их свойства и использование в различных химических процессах.
Физические свойства трехвалентных амфотерных соединений

Одним из физических свойств трехвалентных амфотерных соединений является их способность к растворению в различных растворителях. Такие соединения могут быть растворимыми в воде, а также в органических растворителях, таких как этиловый спирт или ацетон.
Помимо растворимости, трехвалентные амфотерные соединения также обладают электрохимической активностью. Их можно использовать в качестве активных компонентов при электролизе или в качестве катализаторов в различных химических реакциях.
Из-за своей способности проявлять как кислотные, так и основные свойства, трехвалентные амфотерные соединения могут образовывать широкий спектр солей. Это делает их важными в химической промышленности, а также в производстве лекарственных препаратов.
Физические свойства трехвалентных амфотерных соединений могут быть изменены с помощью изменения условий окружающей среды, таких как температура или рН раствора. Это позволяет контролировать их реакционную активность и использовать их в различных приложениях.
Основные способы определения амфотерных оксидов

Существует несколько основных способов определения амфотерных оксидов:
1. Наблюдение за реакцией с кислотами
Один из способов определения амфотерных оксидов – наблюдение за реакцией с кислотами. Если оксид образует с кислотой соль и воду, то он является амфотерным. Например, оксид алюминия (Al2O3) реагирует с соляной кислотой (HCl) и образует соль алюминия (AlCl3) и воду (H2O).
2. Взаимодействие с щелочами
Другой способ определения амфотерных оксидов – их взаимодействие с щелочами. Если оксид реагирует с щелочью и образует соль и воду, то он является амфотерным. Например, оксид цинка (ZnO) реагирует с гидроксидом натрия (NaOH) и образует соль цинка (Na2ZnO2) и воду (H2O).
3. Реакция с индикаторами
Третий способ определения амфотерных оксидов – реакция с индикаторами. Амфотерные оксиды могут проявлять разные окраски, в зависимости от среды, в которой они находятся. Например, оксид железа (Fe2O3) окрашивает раствор фенолфталеина в розовый цвет в кислой среде и в безцветный в щелочной среде.
Классификация амфотерных гидроксидов по типу элемента

- Алюминиевые гидроксиды - амфотерные соединения, которые проявляют свойства как кислоты, так и основания при реакции с различными веществами. Они широко используются в промышленности, включая производство лекарственных препаратов и жиров для косметики.
- Цинковые гидроксиды - еще один пример амфотерного соединения, которое обладает свойствами кислоты и основания в зависимости от среды реакции. Этот вид гидроксидов часто используется в качестве катализаторов в химических процессах.
- Силикатные гидроксиды - класс амфотерных гидроксидов, которые содержат силиций в своей структуре. Они являются важными компонентами многих минералов и строительных материалов.
Таким образом, классификация амфотерных гидроксидов по типу элемента позволяет лучше понять их свойства и применения. Каждый тип гидроксида имеет свои особенности и может проявлять разные реакции в разных условиях.