Концентрация раствора - это один из ключевых понятий в химии, необходимых для выполнения различных расчетов. Эта величина показывает, сколько вещества содержится в определенном объеме раствора. Знание концентрации раствора позволяет определить его физические и химические свойства, а также использовать его в различных процессах и экспериментах. В этой статье мы рассмотрим примеры и методы расчета концентрации раствора.
Существует несколько способов выражения концентрации раствора: массовая (г/мл), объемная (мл/мл) и молярная (моль/л). Все они имеют свои особенности и применяются в зависимости от конкретной ситуации. Расчет концентрации раствора может быть простым или сложным, в зависимости от предоставленных данных и требуемого результата.
Пример расчета концентрации раствора может быть следующим: предположим, что у вас есть 20 г соли, растворенной в 100 мл воды. Для определения массовой концентрации необходимо разделить массу растворенного вещества на объем растворителя: 20 г / 100 мл = 0,2 г/мл. Таким образом, массовая концентрация раствора составляет 0,2 г/мл.
В химии существует несколько специальных методик для более сложных расчетов концентрации раствора. Одним из них является использование молярности (моль/л), которая показывает количество вещества в одном литре раствора. Если вам известна молярная масса растворенного вещества и объем раствора, можно легко рассчитать молярную концентрацию. Например, если у вас есть 50 ммоль кислоты, растворенной в 250 мл растворителя, молярная концентрация будет равна 50 ммоль / 0,25 л = 200 ммоль/л.
Что такое концентрация раствора в химии?
Одним из наиболее распространенных способов измерения концентрации раствора является молярность. Молярность определяет количество моль растворенного вещества в одном литре раствора и обозначается символом "М". Она позволяет более точно описать концентрацию раствора, учитывая количество молекул или ионов в растворе.
Еще одним показателем концентрации раствора является процентная концентрация. Она определяет отношение массы растворенного вещества к общей массе раствора и выражается в процентах. Процентная концентрация может быть как массовой, так и объемной, в зависимости от того, какие физические величины применяются в расчетах.
В химии также используется понятие моляльности - концентрации раствора, выраженной количеством моль растворенного вещества в одном килограмме растворителя. Моляльность обозначается символом "м" и позволяет более точно оценить количественное соотношение между растворенным веществом и растворителем.
Знание концентрации раствора в химии важно для проведения экспериментов, приготовления растворов, а также для определения физико-химических свойств веществ.
Зачем нужно знать концентрацию раствора?
Знание концентрации раствора в химии имеет большое значение и применимо во многих областях. Вот несколько основных причин, почему важно знать концентрацию раствора:
- Дозирование веществ: Зная концентрацию раствора, можно правильно рассчитать необходимое количество вещества для достижения определенного эффекта. Это особенно важно в фармацевтической промышленности, где точность дозирования играет критическую роль в производстве лекарственных препаратов.
- Химические реакции: Зная концентрацию раствора, можно определить соотношение реагентов, необходимых для проведения определенной химической реакции. Это позволяет более эффективно проводить синтез химических веществ и контролировать процесс реакции.
- Анализ образцов: В химической аналитике знание концентрации раствора позволяет определить содержание определенного вещества в растворе или образце. Это может быть полезно, например, в медицинской диагностике, качественном и количественном анализе воды и других жидкостей.
- Упрощение экспериментов: Зная концентрацию раствора, можно легче планировать и проводить химические эксперименты. Концентрация раствора может служить величиной, по которой удобно настраивать экспериментальные условия и управлять процессом.
Все эти причины подтверждают, что знание концентрации раствора является одним из ключевых компонентов успешной работы в химической области и делает возможными множество приложений и открытий.
Как измеряется концентрация раствора?

Наиболее распространенными методами измерения концентрации раствора являются:
- Массовая концентрация - это отношение массы растворенного вещества к объему растворителя, выраженное в граммах на литр (г/л). Для определения массовой концентрации необходимо знать массу растворенного вещества и объем растворителя. Этот метод измерения широко используется в химической лаборатории.
- Молярная концентрация - это отношение числа молей растворенного вещества к объему растворителя, выраженное в молях на литр (моль/л). Для определения молярной концентрации необходимо знать количество вещества в молях и объем растворителя. Этот метод измерения часто применяется в химических расчетах и приготовлении растворов.
- Объемная доля - это отношение объема растворенного вещества к объему раствора, выраженное в процентах (%). Объемная доля показывает, сколько объема раствора занимает растворенное вещество. Этот метод измерения часто используется в фармации и медицине.
Таким образом, измерение концентрации раствора зависит от выбранного метода и выражается в соответствующих единицах измерения. Точный расчет концентрации раствора позволяет определить его физические и химические свойства, а также управлять процессом приготовления растворов и их использованием в различных целях.
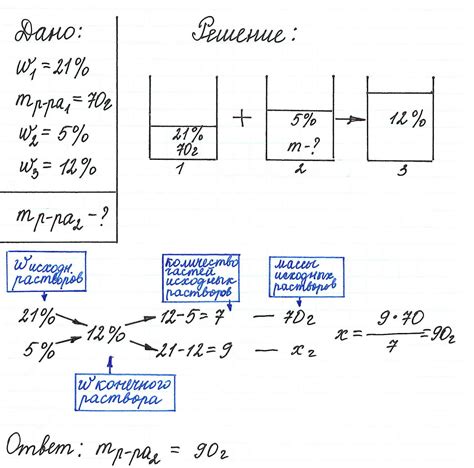
Примеры расчета концентрации раствора

Пример 1:
Найдем массовую долю соли в растворе. Известно, что в 200 г раствора содержится 40 г соли. Чтобы найти массовую долю, необходимо разделить массу соли на массу раствора и умножить результат на 100%:
Массовая доля = (масса соли / масса раствора) * 100%
В данном примере:
Массовая доля = (40 г / 200 г) * 100% = 20%
Таким образом, массовая доля соли в растворе составляет 20%.
Пример 2:
Найдем молярную концентрацию раствора. Известно, что в 500 мл раствора содержится 0,3 моль вещества. Для расчета молярной концентрации необходимо разделить количество вещества на объем раствора:
Молярная концентрация = количество вещества / объем раствора
В данном примере:
Молярная концентрация = 0,3 моль / 0,5 л = 0,6 М
Таким образом, молярная концентрация раствора равна 0,6 М.
Примеры расчета концентрации раствора помогут вам лучше понять и овладеть методами расчета в химии. Запомните основные формулы и необходимые шаги, чтобы уверенно выполнять такие расчеты.
Массовая доля и объемная доля в расчете концентрации
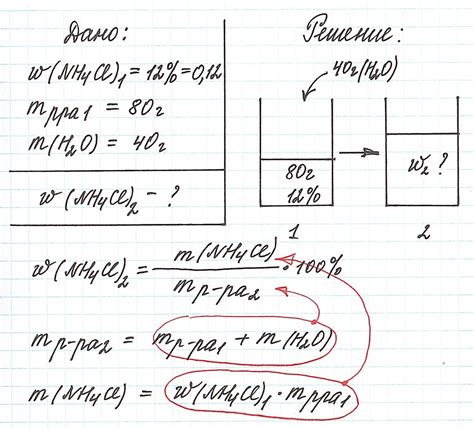
Расчет концентрации раствора в химии может выполняться с использованием различных параметров, включая массовую долю и объемную долю.
Массовая доля (массовый процент) указывает на количество массы определенного вещества в растворе по отношению к общей массе раствора. Она вычисляется путем деления массы вещества на общую массу раствора и умножения на 100. Массовая доля выражается в процентах и обозначается символом "%".
Объемная доля (объемный процент) показывает количество объема определенного компонента в растворе относительно общего объема раствора. Измеряется в процентах и обозначается символом "%". Объемная доля вычисляется путем деления объема вещества на полный объем раствора и умножения на 100.
Для выполнения расчетов концентрации раствора с использованием массовой доли или объемной доли, необходимо знать массу или объем каждого компонента вещества и общую массу или объем раствора. Это может быть полезно при проведении химических реакций, измерении эффективности растворов или при подготовке растворов к экспериментам или анализам.
Как найти молярность раствора?

Для расчета молярности раствора необходимо знать количество вещества (в молях) и объем растворителя (в литрах). Формула расчета молярности следующая:
Молярность = количество вещества ÷ объем растворителя
Если, например, у вас есть 0,5 моль соли, растворенной в 1 литре воды, то молярность раствора будет равна 0,5 М (моль на литр).
Молярность раствора может быть использована для решения различных химических задач, например, расчета массы или объема вещества, необходимого для приготовления определенного раствора с заданной концентрацией.
Расчет процентного содержания вещества в растворе

Для расчета процентного содержания вещества (массовой доли) в растворе следует использовать следующую формулу:
Массовая доля (%) = (масса вещества / масса раствора) * 100
Например, если известно, что в 200 граммах раствора содержится 40 граммов вещества, то процентное содержание вещества будет равно:
Процентное содержание вещества = (40 / 200) * 100 = 20%
Таким образом, в данном примере 20% раствора составляет вещество.
Расчет процентного содержания вещества позволяет определить, насколько раствор концентрирован и какая доля его состоит из единицы вещества. Этот метод широко используется в химическом анализе, фармацевтике, пищевой промышленности и других сферах науки и промышленности. Точные значения процентного содержания вещества позволяют контролировать качество растворов и оптимизировать процессы производства.
Как использовать мольную долю в расчете концентрации

Для расчета мольной доли определенного компонента в смеси или растворе, необходимо знать массу данного компонента и общую массу всех компонентов. Мольная доля вычисляется по формуле:
| Мольная доля (Xi) | = | Масса компонента (mi) | / | Общая масса всех компонентов (mобщ) |
|---|---|---|---|---|
Для каждого компонента в смеси или растворе | ||||
Применение мольной доли в расчете концентрации может быть полезным при вычислении массовой концентрации или молярной концентрации раствора. Например, если известна мольная доля компонента в смеси и общий объем или масса смеси, можно рассчитать его концентрацию. Для этого можно использовать следующую формулу:
| Концентрация (Ci) | = | Мольная доля (Xi) | * | Мольная масса компонента (Mi) |
|---|---|---|---|---|
Для каждого компонента в смеси или растворе | ||||
Наличие точной мольной доли позволяет проводить различные химические расчеты и определять величину концентрации раствора с высокой точностью. Это соответствует основным принципам количественного анализа в химической науке.
Таким образом, знание и применение мольной доли позволяет более точно изучать концентрацию раствора и проводить химические расчеты, имея только информацию о массах компонентов смеси или раствора.
В чем разница между насыщенным и пересыщенным растворами?

Растворы в химии могут быть насыщенными или пересыщенными в зависимости от количества растворенного вещества, которое они содержат.
Насыщенный раствор образуется, когда растворное вещество полностью растворяется в растворителе при данной температуре и давлении. В насыщенном растворе концентрация растворенного вещества достигает предела растворимости и остается постоянной при дальнейшем перемешивании.
Пересыщенный раствор содержит больше растворенного вещества, чем могло бы раствориться при данной температуре и давлении. Это может быть достигнуто, например, путем нагревания раствора или медленного охлаждения, что повышает предел растворимости вещества.
Если в пересыщенном растворе появится дополнительное растворенное вещество или если произойдет изменение температуры или давления, то часть избыточного растворенного вещества может выделиться в виде кристаллов или выпасть из раствора. Этот процесс называется кристаллизацией и позволяет превратить пересыщенный раствор в насыщенный.
Важно иметь в виду разницу между насыщенными и пересыщенными растворами при работе с химическими реакциями и при проведении измерений, так как концентрация раствора может влиять на результаты и процессы в химическом эксперименте.