Парциальное давление – важное понятие в химии, физике и термодинамике, которое определяет долю общего давления, которую вносит отдельный компонент в смеси газов или растворов. Определение парциального давления паров раствора необходимо для понимания свойств и поведения растворов, а также для проведения различных химических и физических экспериментов.
Основной метод определения парциального давления паров раствора основан на законе Рауля. Закон Рауля гласит, что парциальное давление компонента в паровой фазе является пропорциональным его концентрации в растворе. Иными словами, чем больше концентрация компонента в растворе, тем выше его парциальное давление. Это значит, что для определения парциального давления паров раствора необходимо знать концентрацию компонента в растворе.
Определение концентрации компонента в растворе может быть произведено различными методами, в зависимости от его химических свойств и природы. Например, для газов можно использовать методы хроматографии или спектроскопии, а для жидкостей – вязкомеры или плотномеры. После определения концентрации компонента в растворе, можно легко вычислить его парциальное давление с помощью пропорциональности, установленной законом Рауля.
Парциальное давление паров раствора: что это?

Парциальное давление паров раствора зависит от концентрации растворенного вещества и температуры. По мере увеличения концентрации растворенного вещества парциальное давление также возрастает. Температура также оказывает влияние на парциальное давление: с повышением температуры парциальное давление увеличивается.
Для определения парциального давления паров раствора часто используется таблица парциальных давлений. В этой таблице перечислены значения парциального давления для различных растворов при определенной температуре. Поэтому, зная концентрацию растворенного вещества и температуру, можно определить парциальное давление паров раствора.
| Концентрация вещества | Температура | Парциальное давление паров раствора |
|---|---|---|
| 0.1 M | 25°C | 0.74 atm |
| 0.2 M | 25°C | 1.48 atm |
| 0.1 M | 50°C | 1.11 atm |
| 0.2 M | 50°C | 2.22 atm |
Закон парциальных давлений (закон Рауля) утверждает, что парциальное давление паров раствора равно произведению парциального давления чистого растворимого вещества на его мольную долю в растворе. Этот закон позволяет определить парциальное давление, если известно парциальное давление чистого вещества и его концентрация в растворе.
Парциальное давление паров раствора играет важную роль во многих физических и химических явлениях, таких как фазовые переходы, выравнивание концентраций между фазами и определение температурной зависимости растворимости веществ.
Определение понятия парциального давления паров раствора

Парциальное давление паров раствора зависит от концентрации растворенных веществ, температуры и физико-химических свойств раствора. Чем выше концентрация раствора или температура, тем выше парциальное давление.
Парциальное давление паров раствора играет важную роль в ряде процессов, таких как испарение, кипение и диффузия. Оно может быть определено с помощью различных методов, включая прямое измерение с помощью манометра или использование закона Рауля – закона парциальных давлений.
Как парциальное давление влияет на равновесие раствора
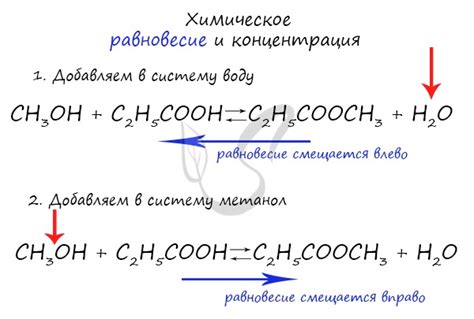
Равновесие раствора определяется парциальным давлением паров растворителя и растворимого вещества. Парциальное давление представляет собой давление, которое молекулы растворителя или растворимого вещества создают, находясь в газовой фазе над поверхностью раствора при заданной температуре.
Парциальное давление влияет на равновесие раствора, потому что оно является ключевым фактором, определяющим, в каком направлении будет протекать процесс перехода молекул из газовой фазы в жидкую и наоборот.
Если парциальное давление растворителя над раствором велико, то молекулы растворителя активно переходят в газовую фазу. Это приводит к увеличению концентрации растворителя в газовой фазе и увеличению его парциального давления. Такое равновесие называется "диссоциативным равновесием", где процесс диссоциации преобладает над обратной реакцией.
С другой стороны, если парциальное давление растворимого вещества над раствором высоко, то молекулы растворимого вещества активно переходят в жидкую фазу. Это приводит к увеличению концентрации растворимого вещества в жидкой фазе и увеличению его парциального давления. Такое равновесие называется "ассоциативным равновесием", где процесс ассоциации преобладает над обратной реакцией.
| Давление раствора | Влияние на равновесие |
|---|---|
| Высокое парциальное давление растворителя | Диссоциативное равновесие |
| Высокое парциальное давление растворимого вещества | Ассоциативное равновесие |
Таким образом, понимание влияния парциального давления на равновесие раствора является важным для понимания процессов диссоциации и ассоциации при растворении веществ. Это позволяет более точно предсказывать поведение растворов и контролировать условия их образования.
Методы измерения парциального давления

1. Микрометрический метод:
Метод заключается в использовании микрометра для измерения объема газа, вытесняемого паром раствора. Парциальное давление определяется путем измерения изменения объема газа при добавлении определенного количества раствора и замера объема газа после достижения состояния равновесия.
2. Манометрический метод:
Для измерения парциального давления применяется манометр. Обычно используются две камеры – одна заполнена раствором, а другая заполнена газом, парциальное давление которого нужно измерить. Парциальное давление раствора можно определить, сравнивая разницу в высоте ртутного столба в обоих камерах.
3. Тепловой метод:
Этот метод основан на использовании свойств равновесия при определении парциального давления. Меняя температуру, можно установить равновесие между газообразным веществом и его паром. Затем измеряются изменения тепловых параметров (температура, теплопроводность и т. д.), чтобы определить парциальное давление.
4. Абсорбционный метод:
Этот метод основан на измерении изменения концентрации компонента в газовой фазе после его поглощения раствором. С помощью специальных аппаратов можно определить количество поглощенного газа и соответствующее парциальное давление.
5. Электрический метод:
Этот метод основан на использовании свойств электрической проводимости при измерении парциального давления. Измеряется электрическое сопротивление раствора, которое зависит от концентрации растворенных газов. Парциальное давление можно определить, сравнивая изменения в электрической проводимости раствора.
Практическое применение определения парциального давления
Определение парциального давления паров раствора имеет широкое практическое применение в различных областях науки и технологий.
В химической промышленности знание парциального давления паров растворов помогает контролировать процессы испарения и конденсации в различных устройствах, таких как колонны для получения высокочистых продуктов или аппараты для сушки веществ. Зная парциальное давление каждого компонента раствора, можно оптимизировать эти процессы, повысить эффективность и качество производства.
В медицине и фармакологии знание парциального давления паров раствора играет важную роль, например, при определении дозировки и выработке правильного режима применения лекарственных препаратов. Парциальное давление паров раствора также учитывается при проектировании систем доставки лекарств, чтобы обеспечить достаточное количество активного вещества в организме пациента.
В области пищевой промышленности парциальное давление паров растворов используется, например, для определения оптимальных условий приготовления пищевых продуктов, таких как конфеты или приправы. Знание парциального давления позволяет контролировать и регулировать процессы увлажнения и конденсации в продукции, что влияет на ее текстуру, вкус и сохранность.
Также парциальное давление паров растворов активно используется в области экологии и охраны окружающей среды. При изучении взаимодействия различных веществ с атмосферой и их влияния на климат парциальное давление играет важную роль. Знание парциального давления паров позволяет оценить концентрацию различных веществ в атмосфере и прогнозировать их воздействие на окружающую среду.
Таким образом, понимание и использование определения парциального давления паров раствора имеет широкие практические применения в различных областях науки и технологий, позволяя оптимизировать процессы, контролировать и регулировать качество продукции и охранять окружающую среду.