В химии равновесие играет важную роль, особенно при рассмотрении концентрации вещества. Равновесная концентрация – это та концентрация, при которой скорости прямой и обратной реакции становятся равными. Поиск равновесной концентрации может быть непростой задачей, но с правильным подходом и знанием основных принципов вы сможете справиться с этой задачей.
Первый шаг в поиске равновесной концентрации вещества – установление химического уравнения реакции. Это уравнение показывает, какие вещества реагируют между собой и какие продукты образуются в результате реакции. Зная химическое уравнение, вы сможете понять, какие исходные концентрации вещества будут влиять на равновесную концентрацию.
Важно учитывать, что концентрация вещества может различаться в разных условиях, например, в разных реакционных системах или при разных температурах. Поэтому для определения равновесной концентрации необходимо учитывать все факторы, влияющие на данную реакцию.
Определение равновесной концентрации

Определение равновесной концентрации может быть важным шагом для анализа и предсказания результатов химической реакции. Для этого можно использовать различные методы и подходы.
1. Концентрация продуктов и реагентов: Для определения равновесной концентрации вещества можно измерить концентрацию продуктов и реагентов в определенный момент времени. При достижении равновесия концентрации будут оставаться постоянными.
2. Использование равновесной постоянной: Равновесная постоянная является важным параметром химической реакции, который позволяет определить отношение концентраций продуктов и реагентов в равновесии. Использование математических уравнений и равновесных постоянных позволяет вычислить равновесную концентрацию.
3. Моделирование и эксперименты: Для определения равновесной концентрации можно также использовать математическое моделирование и проведение экспериментов. Это позволяет исследовать различные условия реакции и определить оптимальные равновесные условия.
Определение равновесной концентрации вещества требует внимательного анализа и рассмотрения всех факторов, влияющих на процесс химической реакции. Правильная оценка равновесной концентрации позволяет более точно предсказывать результаты реакции и оптимизировать условия для достижения требуемых значений.
Факторы, влияющие на равновесную концентрацию
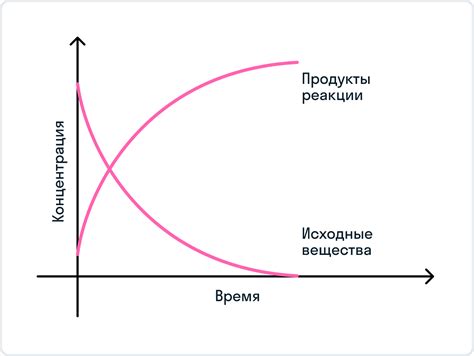
Равновесная концентрация вещества зависит от нескольких факторов, которые оказывают непосредственное влияние на химическую реакцию. Важно учитывать эти факторы при проведении экспериментов и анализе данных.
Температура: Изменение температуры может привести к изменению равновесной концентрации вещества. В некоторых реакциях повышение температуры приводит к увеличению равновесной концентрации, в то время как в других реакциях оно может вызвать обратный эффект – снижение концентрации.
Давление: В некоторых реакциях изменение давления влияет на равновесную концентрацию вещества. Возможны случаи, когда повышение давления приводит к повышению концентрации, а в других реакциях – к снижению. Необходимо учитывать исходные условия реакции для правильного определения влияния давления на концентрацию вещества.
Концентрация реагентов: Исходное количество реагентов также влияет на равновесную концентрацию вещества. При изменении концентрации реагентов может измениться концентрация продуктов или обратной реакции.
Катализаторы: Наличие катализаторов может ускорить химическую реакцию и повлиять на равновесную концентрацию вещества. Катализаторы обычно не изменяют итоговую концентрацию, но могут уменьшить время, необходимое для достижения равновесия.
Распределение по объему: Объемы реакционных сосудов также могут влиять на равновесную концентрацию вещества. Изменение объема может привести к изменению концентрации, особенно в системах, где газы присутствуют в реакции.
Учитывая все эти факторы, можно более точно определить равновесную концентрацию вещества и понять, как меняются его свойства при изменении условий реакции.
Принцип равновесных состояний
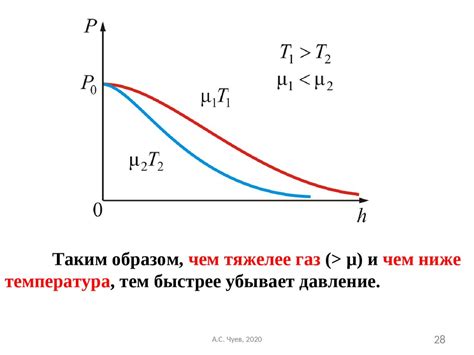
Для применения принципа равновесных состояний необходимо знать уравнение реакции и значение постоянной равновесия. Постоянная равновесия определяет, насколько полная или неполная является реакция при заданной температуре и давлении.
Применение принципа равновесных состояний позволяет рассчитать концентрацию вещества в равновесной системе, даже если начальные концентрации известны. Он основан на следующих шагах:
- Написать уравнение реакции и записать значение постоянной равновесия.
- Задать начальные концентрации вещества.
- Предположить, что реакция достигла равновесия и определить неизвестные концентрации при помощи переменных.
- Написать уравнения массового действия для обратной и прямой реакций и установить их равенство.
- Решить уравнения для определения концентраций неизвестных веществ.
Принцип равновесных состояний является важным инструментом для понимания и решения химических реакций. Он позволяет определить равновесную концентрацию вещества и предсказать изменение состояния системы при различных условиях.
Влияние температуры на равновесную концентрацию

При повышении температуры, обычно, наблюдается увеличение концентрации продуктов реакции. Это происходит из-за того, что при повышенной температуре реакции протекают быстрее, и больше молекул превращается в продукты реакции.
Однако, есть и исключения. В некоторых реакциях повышение температуры может привести к снижению концентрации продуктов. Это объясняется тем, что некоторые реакции являются экзотермическими, то есть выделяют тепло. При повышенной температуре энергия активации реакции может быть ниже, и реакция протекает обратно, образуя больше реагентов.
Изменение температуры также может изменить равновесную константу реакции. В некоторых случаях, повышение температуры приводит к увеличению равновесной константы, что означает, что продукты реакции становятся более выгодными с точки зрения энергетического равновесия.
Использование катализаторов для достижения равновесия
В процессе химической реакции равновесие достигается, когда скорости прямой и обратной реакции становятся равными. Однако, в некоторых случаях достижение равновесия может занимать слишком много времени или быть неполным. В таких случаях использование катализаторов может способствовать более быстрому и полному достижению равновесия.
Катализаторы - это вещества, которые не влияют на саму химическую реакцию, но присутствие которых ускоряет ее протекание. Катализаторы представляют собой вещества, которые способны предоставить подходящие условия для изменения скорости и направления реакции. Они могут снижать активационную энергию реакции или обеспечивать новые пути протекания реакций, что способствует переходу системы в равновесное состояние.
Применение катализаторов особенно полезно, когда равновесная концентрация вещества достигается долго или не полностью. Катализаторы позволяют сократить время реакции и увеличить выход желаемого продукта. Кроме того, использование катализаторов может снизить стоимость реакции, поскольку они сами не расходуются в ходе процесса и могут быть использованы многократно.
При выборе катализатора для конкретного процесса необходимо учитывать его активность, специфичность и стабильность. Активность катализатора определяет его способность повысить скорость реакции, специфичность - его способность влиять только на конкретные реакции, а стабильность - его способность сохранять эффективность в течение длительного времени.
Использование катализаторов для достижения равновесия является важным инструментом в современной химии. Оно позволяет оптимизировать процессы реакции, экономя время и ресурсы. Поэтому выбор правильного катализатора и его грамотное использование могут стать ключевыми факторами в достижении равновесия в химической системе.
Прежде чем приступить к использованию катализаторов, необходимо провести тщательное исследование и анализ, чтобы выбрать наиболее подходящий катализатор для конкретного процесса. Также следует учитывать возможные нежелательные побочные эффекты, а также соблюдать все остальные условия реакции для достижения наилучших результатов.
Методы измерения равновесной концентрации

Для определения равновесной концентрации вещества существует несколько методов, которые широко используются в химическом анализе:
Спектрофотометрический метод: данный метод основан на измерении поглощения или пропускания электромагнитного излучения веществом. По закономерностям изменения интенсивности поглощенного или прошедшего излучения можно определить концентрацию вещества в растворе.
Электрохимический метод: данный метод основан на измерении электрических свойств раствора, таких как потенциал, ток или заряд. С помощью электрохимических методов можно определить концентрацию вещества в растворе, а также изучать его реакционную активность.
Титриметрический метод: данная методика основывается на определении объема реагента, необходимого для полного превращения вещества в растворе. Титриметрические методы позволяют определить концентрацию вещества с высокой точностью и точностью, однако требуют наличия соответствующих реагентов и оборудования.
Масс-спектрометрический метод: данный метод основан на анализе масс-заряда ионов вещества в газовой фазе. Масс-спектрометрические методы позволяют определить состав и концентрацию вещества в сложных смесях.
Выбор метода измерения равновесной концентрации зависит от характера вещества, наличия необходимого оборудования и требуемой точности результатов.
Советы по поиску равновесной концентрации
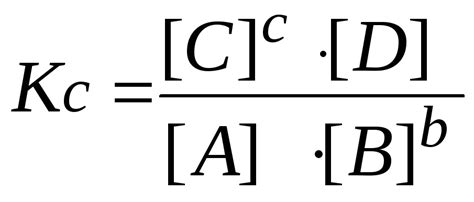
1. Используйте химическое уравнение: Начните с химического уравнения реакции, включающей вещество, концентрацию которого вы хотите найти. Учитывайте также присутствие других реагентов и промежуточных продуктов.
2. Изучите химическую реакцию: Узнайте, какие факторы влияют на равновесную концентрацию вещества. Это могут быть температура, давление, концентрация других реагентов или катализаторов.
3. Проведите эксперименты: Используйте данные опытов и измерений, чтобы определить зависимость концентрации исследуемого вещества от различных факторов. Запишите результаты и изучите их тщательно.
| Фактор | Влияние на равновесную концентрацию |
|---|---|
| Температура | Увеличение температуры может привести к увеличению или уменьшению концентрации вещества в зависимости от характера реакции. |
| Давление | Изменение давления может изменить концентрацию вещества только в случае, если оно присутствует в форме газа. |
| Концентрация других реагентов | Увеличение или уменьшение концентрации других реагентов может влиять на равновесную концентрацию исследуемого вещества. |
| Катализаторы | Наличие катализаторов может повышать скорость реакции, но не влиять значительно на равновесную концентрацию вещества. |
4. Используйте математические методы: Применяйте математические методы, такие как вычисление константы равновесия и уравнения реакции, чтобы определить равновесную концентрацию вещества.
Помните, что поиск равновесной концентрации вещества может потребовать некоторого времени и терпения. Внимательно анализируйте данные и проводите эксперименты, учитывайте все факторы и используйте математические методы, чтобы получить точные результаты.
Особенности поиска равновесной концентрации в разных системах
В системах с однородным составом, таких как растворы, равновесная концентрация может быть достигнута путем смешивания и перемешивания вещества. Здесь можно определить равновесие концентрации, контролируя время, необходимое для достижения стабильного состояния.
В случае неоднородных систем, таких как газовые смеси или реакции в твердой фазе, поиск равновесной концентрации может быть более сложным процессом. Кроме того, факторы, такие как давление и температура, могут оказывать существенное влияние на равновесную концентрацию вещества.
Для поиска равновесной концентрации в газовых системах, необходимо учитывать принцип Ле Шателье и использовать уравнение состояния газа. Также важно учитывать изменение давления и температуры, которые могут привести к сдвигу равновесия в сторону исходных реагентов или продуктов реакции.
В случае реакций в твердой фазе, поиск равновесной концентрации может быть более сложным процессом, так как реакция может проходить со скоростью, зависящей от поверхности твердого вещества. В этом случае необходимо учитывать площадь поверхности и процессы адсорбции и десорбции, которые могут оказывать влияние на равновесную концентрацию вещества.
В итоге, поиск равновесной концентрации в разных системах требует учета специфических особенностей каждой системы и использования соответствующих методов и уравнений.
Экспериментальное определение равновесной концентрации

Для определения равновесной концентрации вещества в реакции можно провести эксперимент, в котором будет измеряться концентрация вещества в разные моменты времени после достижения равновесия. Важно иметь в виду, что равновесие в реакции может быть достигнуто только в том случае, если реакция проходит в закрытой системе, то есть без обмена веществом с окружающей средой.
Для эксперимента необходимо подготовить пробу реакционной смеси, в которой заданы начальные концентрации реагентов. Следует также определить способ, с помощью которого будет измеряться концентрация вещества. Для этого может быть использовано оборудование, такое как фотометр, потенциометр или спектрофотометр.
После приготовления реакционной смеси и установления начальных концентраций реагентов, начинается отсчет времени. Важно регулярно отбирать образцы реакционной смеси и измерять их концентрацию вещества. Сделать это можно путем взятия пробы с бюркеттовым краном и последующим анализом содержания вещества в пробе.
Образцы обычно отбираются через равные промежутки времени, чтобы иметь возможность отследить изменение концентрации вещества во время протекания реакции. Измеренные данные затем заносятся в таблицу или график в зависимости от времени.
Примеры применения равновесной концентрации

Равновесная концентрация вещества играет важную роль во множестве областей, где требуется строгое соблюдение равновесия системы. Ниже приведены несколько примеров применения равновесной концентрации в различных областях:
Химическая реакция: При изучении химических реакций, равновесная концентрация вещества помогает определить, какие продукты реакции будут образовываться при заданных условиях и какие будут равновесные концентрации реагентов и продуктов.
Медицина: В фармакологии равновесная концентрация используется для определения оптимальных доз медицинских препаратов, чтобы достичь желаемого терапевтического эффекта без нежелательных побочных реакций.
Экология: В изучении экологических систем равновесная концентрация вещества помогает определить уровень загрязнения и его влияние на окружающую среду.
Производство: В промышленности равновесная концентрация используется для определения оптимальных условий производства, чтобы достичь максимальной эффективности и минимизировать затраты ресурсов.
Биология: В биологических системах равновесная концентрация вещества помогает понять, какие факторы влияют на баланс внутренней среды организма и способствуют его нормальному функционированию.
Это только некоторые из множества областей, где равновесная концентрация вещества играет важную роль. Понимание и применение этого концепта позволяют более точно анализировать и контролировать процессы, происходящие в различных системах.