Атомный радиус – это важная характеристика атомов, которая определяет их размеры. Важно правильно выбрать радиус атома, так как это может существенно влиять на его химические свойства и взаимодействия с другими атомами. В этой статье мы рассмотрим несколько полезных советов и рекомендаций, которые помогут вам выбрать атомный радиус для вашей конкретной задачи.
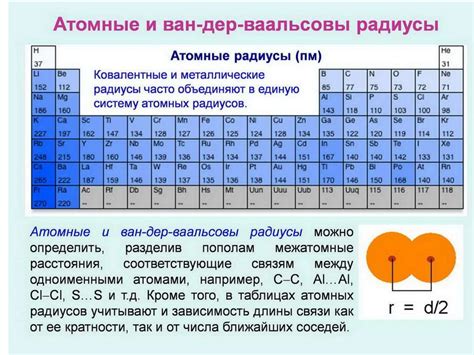
Во-первых, при выборе атомного радиуса следует обратить внимание на периодическую таблицу элементов. Она является незаменимым инструментом при определении радиуса атома. Обратите внимание на расположение интересующего вас элемента в таблице и узнайте его атомный радиус из соответствующих источников информации.
Во-вторых, учитывайте, что атомные радиусы могут изменяться в зависимости от окружения и условий. Например, атомный радиус может быть разным для атома в свободном состоянии, в молекуле или в кристаллической решетке. Поэтому важно выбирать радиус, соответствующий конкретному состоянию атома, в котором он применяется.
Наконец, не забывайте о том, что атомный радиус может быть разным для различных изотопов одного и того же элемента. Изотопы могут иметь немного разные массы и нуклоны, и это может повлиять на их атомные радиусы. При выборе атомного радиуса учтите конкретный изотоп и его химические свойства, чтобы получить наиболее точный результат.
Определение атомного радиуса

Существует несколько способов определения атомного радиуса. Один из них - измерение дифракции рентгеновского или нейтронного излучения. Этот метод основан на том, что длина волны рентгеновского или нейтронного излучения примерно равна радиусу атома. Путем измерения дифракции можно рассчитать атомные радиусы различных элементов.
Другой способ - определение атомного радиуса с использованием рентгеноструктурного анализа кристаллических структур. Этот метод заключается в измерении расстояний между атомами в кристаллической решетке и последующем расчете радиусов атомов.
Также существуют теоретические модели, позволяющие предсказывать атомные радиусы на основе электронной конфигурации атома и его положения в периодической таблице элементов.
Необходимо отметить, что атомный радиус является статистической величиной, так как атомы могут иметь различные радиусы в зависимости от условий их окружения и структуры.
Роль атомного радиуса в химии

В таблице периодов Менделеева, атомы расположены в порядке возрастания атомного номера и увеличения атомного радиуса по горизонтали. Это позволяет установить закономерности в свойствах элементов и предсказать их химическое поведение.
Чем больше атомный радиус, тем больше электронных оболочек может вместить атом, а значит, у него будет больше возможных соединений. Кроме того, атомы с большим радиусом проявляют меньшую электростатическую силу притяжения наружу, что делает их более реакционноспособными.
На основе атомного радиуса, можно также предсказывать свойства молекул и химических соединений. Например, между атомными радиусами атомов в молекуле можно определить длины связей и углы между ними. Это дает возможность представить пространственную структуру молекулы и понять её химическую активность.
| Свойство | Зависимость от атомного радиуса |
|---|---|
| Химическая реакционность | Чем больше атомный радиус, тем выше реакционная способность |
| Связевая энергия | Связь с атомом меньшего радиуса обычно является более прочной |
| Растворимость | Атомы с большим радиусом обладают большей растворимостью |
Таким образом, атомный радиус играет ключевую роль в химии, определяя свойства атомов, молекул и химических соединений. Понимание его значения помогает установить взаимосвязи между различными элементами и предсказать их поведение в химических реакциях.
Параметры влияющие на атомный радиус
| Фактор | Влияние |
| Атомное число | Чем больше атомное число, тем больше атомный радиус |
| Ядерный заряд | Чем больше заряд ядра атома, тем меньше атомный радиус |
| Метод измерения | Различные методы измерения могут давать разные значения радиуса |
| Электронная структура | Количество электронов в атоме и их расположение влияют на атомный радиус |
| Сродство к электронам | Связь атома с электронами влияет на его радиус |
| Состояние атома (ионное или нейтральное) | Ионные атомы имеют разные радиусы в зависимости от заряда |
Важно помнить, что атомный радиус - это среднее значение и может варьироваться в разных условиях. Несмотря на это, знание параметров, влияющих на его изменение поможет в выборе нужного атомного радиуса при проведении исследований или расчетах.
Методы измерения атомного радиуса

| Метод | Описание |
|---|---|
| Рентгеноструктурный анализ | Использует рентгеновское излучение для определения атомных координат и расстояний между атомами в кристаллической структуре. Позволяет точно определить атомные радиусы. |
| Рентгеновская флуоресценция | Применяется для определения атомных радиусов путем измерения энергии излучения, вызванного взаимодействием атома с рентгеновскими лучами. Предоставляет данные о среднем атомном радиусе. |
| Электронная дифракция | Использует взаимодействие электронов с атомами для определения их положения в кристаллической структуре. Позволяет получить значение атомного радиуса. |
| Измерение объемов атомов | Основано на определении объема атомов методами, такими как газовые и жидкостные диффузии, вязкость и плотность. Позволяет оценить атомные радиусы. |
| Теоретические расчеты | Используются математические модели и теоретические аппроксимации для предсказания атомных радиусов и оценки их значений. |
Выбор метода измерения атомного радиуса зависит от конкретной задачи по исследованию и доступных ресурсов. Комбинирование различных методов может дать более точные результаты.
Факторы, влияющие на выбор атомного радиуса
1. Валентность элемента: Атомный радиус может меняться в зависимости от валентности элемента. Как правило, атомы с большим числом внешних электронов (высокая валентность) имеют больший радиус по сравнению с атомами с низкой валентностью.
2. Ядро и электронная оболочка: Размер атома определяется ядром и электронной оболочкой. Влияние ядра ощущается внутри атома, в то время как электронная оболочка определяет его внешний размер. Изменение ядерного заряда или структуры электронной оболочки может привести к изменению атомного радиуса.
3. Электронная плотность: Электронная плотность определяет вероятность нахождения электрона в определенной области вокруг атома. Высокая электронная плотность может привести к увеличению атомного радиуса из-за отталкивания электронов.
4. Ковалентная связь: При образовании ковалентной связи происходит обмен электронами между атомами. Это может привести к изменению атомного радиуса и его уменьшению или увеличению в зависимости от степени обмена электронами и силы связи.
Ученые исследуют и экспериментируют, чтобы более точно определить атомные радиусы различных элементов. Знание факторов, влияющих на выбор атомного радиуса, позволяет лучше понять химические свойства элементов и их взаимодействие в реакциях.