Электрическая диссоциация - это процесс, при котором молекулы кислоты расщепляются на ионы, под влиянием электрического поля. Растворы кислот играют важную роль в химических реакциях и различных процессах, которые происходят в живых организмах и в окружающей среде.
Когда кислоты растворяются в воде, они образуют ионы водорода (H+) и отрицательно заряженные анионы. Этот процесс называется ионизацией или диссоциацией кислоты. Ионы водорода, высвобожденные при растворении кислоты, способны реагировать с другими веществами и участвовать в реакциях обмена и растворения.
Растворы кислот обладают свойством изменять pH. Кислоты, образующие больше ионов водорода, являются сильными кислотами, а кислоты, образующие меньше ионов водорода, являются слабыми кислотами. Это свойство позволяет кислотам влиять на химические реакции, протекающие в растворах, и играть важную роль в жизнедеятельности организмов.
Принципы электрической диссоциации

Основные принципы электрической диссоциации:
- Электролиты и непроводящие вещества: Вещества могут быть классифицированы как электролиты или непроводящие вещества в зависимости от их способности диссоциировать и образовывать в растворе ионы. Электролиты, такие как кислоты, основания и соли, диссоциируют на ионы, что позволяет проводить электрический ток. Непроводящие вещества, такие как вода, органические соединения и некоторые молекулярные соединения, не диссоциируют и не образуют ионов.
- Степень диссоциации: Коэффициент диссоциации определяет, насколько эффективно молекулы диссоциируют в ионы. Этот коэффициент может быть выражен в виде доли или процента. Например, если 50% молекул диссоциировали, коэффициент диссоциации будет равен 0,5 или 50%.
- Принцип Левируса-Гольдберга: Согласно принципу Левируса-Гольдберга, электрическая диссоциация происходит только при взаимодействии растворенного вещества с растворителем, и обратима только для электролитов. Это значит, что ионы могут снова образовывать молекулы и наоборот.
- Ионный радиус и заряд: Размер ионного радиуса и заряд иона влияют на способность молекул диссоциировать. Ионы с большим радиусом или с большим зарядом имеют большую склонность к диссоциации, чем ионы с меньшим радиусом или зарядом.
- Уровень энергии: Для электрической диссоциации необходимо энергия. Вещества с высоким уровнем энергии, такие как кислоты, легче диссоциируются, чем вещества с низким уровнем энергии.
Понимание принципов электрической диссоциации является важным для понимания поведения растворов кислот и их использования в различных областях науки и техники.
Электролиты и свободные ионы
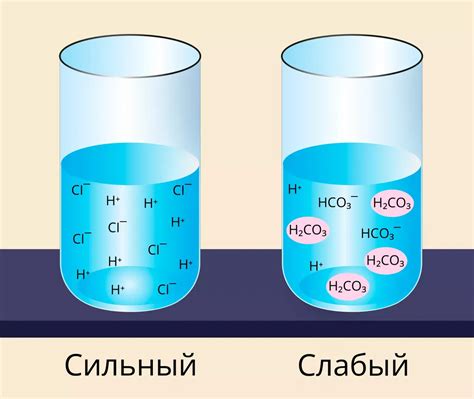
Электролиты, подвергающиеся полному разложению, называются сильными, а те, что разлагаются только частично, - слабыми.
Свободные ионы, возникающие в растворах электролитов, обладают электрическим зарядом и могут свободно двигаться под воздействием электрического поля. Свободные ионы являются основными участниками электролитических процессов и определяют их электропроводность.
Свободные анионы и катионы, образующиеся в результате диссоциации электролита, обычно обозначают специальными химическими символами, например, Cl- для хлорида, Na+ для натрия. Ионы значительно отличаются от атомов, которые состоят из протонов, нейтронов и электронов, образуются во время реакций и обладают зарядом. При этом образование свободных ионов является ключевым моментом в процессе электролитической диссоциации.
Реакция диссоциации и ионизация

Реакция диссоциации и ионизация представляют собой процессы, которые происходят при взаимодействии кислотных растворов с водой.
Диссоциация кислоты происходит при контакте с водой, в результате чего часть молекул кислоты расщепляется на ионы, образуя ионный раствор. Вода, в свою очередь, действует как реагент, принимая эти ионы.
Ионизация происходит при взаимодействии между водой и кислотой, где кислота отдает протон (водородный ион) воде. В результате образуется ионизированная форма кислоты и гидроксидный ион.
Реакция диссоциации и ионизации являются ключевыми понятиями в химии и играют важную роль в понимании свойств кислотных растворов. Они объясняют, почему кислые растворы обладают характерными свойствами, такими как протонная активность, электропроводность и другие.
Объяснение растворов кислот
Растворы кислот представляют собой жидкости, состоящие из молекул кислоты, которая диссоциирует, то есть распадается на ионы, при контакте с водой.
Когда кислота растворяется в воде, происходит электрическая диссоциация, в результате которой образуются положительно и отрицательно заряженные ионы. Положительные ионы называются катионами, а отрицательные - анионами. Таким образом, раствор кислоты становится электролитом, способным проводить электрический ток.
Распад кислоты на ионы происходит полностью или частично в зависимости от свойств самой кислоты и условий растворения. Если кислота диссоциирует полностью, то раствор называется сильным кислотным раствором. Если диссоциация происходит не полностью, то раствор называется слабым кислотным раствором.
Образование ионов в растворе кислоты осуществляется согласно принципу Бронстеда-Лаури. Согласно этому принципу кислота является веществом, способным отдавать протон (водородный ион), а основание - веществом, способным принять протон.
Реакция диссоциации кислоты в растворе может выглядеть следующим образом:
HNO3 (кислота) + H2O (вода) → H3O+ (гидроний) + NO3- (нитрат)
В данной реакции кислота HNO3 отдает протон, образуя гидроний H3O+, а нитратный ион NO3- принимает протон.
Растворы кислот могут проявлять свои кислотные свойства, такие как коррозия, смешение с основаниями, образование солей и т.д. Они также могут иметь различную степень кислотности, которая измеряется с помощью понятия pH.
Важно помнить, что кислоты являются одним из фундаментальных понятий химии и играют важную роль во многих химических процессах и реакциях.
Кислоты и их свойства
Кислоты обладают различными свойствами, которые можно классифицировать в зависимости от их химической структуры и реакционной активности:
| Свойство | Описание |
|---|---|
| Кислотность | Способность давать протоны (водородные ионы) в растворе |
| Коррозивность | Способность разрушать материалы и вызывать образование ржавчины |
| Электролитические свойства | Способность диссоциировать на ионы в растворе и проводить электрический ток |
| Окислительные свойства | Способность окислять другие вещества, при этом сама восстанавливаясь |
| Реакционная активность | Способность участвовать в различных химических реакциях и образовании новых соединений |
Кислотность кислот определяется по их Кислотно-щелочным свойствам, выражаемым с помощью кислотности (pH) и коеффициента диссоциации (Ka). Кислотность прямо связана с содержанием ионов водорода (H+) в растворе, чем выше концентрация этих ионов, тем кислотнее раствор.
Кислоты могут быть органическими и неорганическими. Органические кислоты, такие как уксусная кислота и лимонная кислота, содержат атомы углерода, в то время как неорганические кислоты, такие как серная кислота и соляная кислота, не содержат атомов углерода.
Кислоты широко используются в различных отраслях, таких как химическая промышленность, медицина и пищевая промышленность. Они играют важную роль в регуляции pH, очистке воды, синтезе лекарственных препаратов и многих других процессах.



