Кислоты – это одна из основных групп химических соединений, которые имеют большое значение в нашей жизни. Они используются в различных отраслях промышленности, в медицине, в повседневной жизни. Но все кислоты различаются между собой по своим свойствам и реакционной способности. Однако какие именно критерии определяют степень кислотности среды?
Сильные кислоты – это вещества, которые полностью диссоциируют в водном растворе, то есть разделяются на ионы. Именно благодаря этому сильные кислоты обладают высокой степенью кислотности. К таким кислотам относятся, например, серная или хлористоводородная кислоты. Когда такие кислоты находятся в воде, они полностью распадаются на H+ и соответствующие анионы, образуя ионы водорода. Это направление реакции полностью справедливо только для одной стадии.
Слабые кислоты – это такие кислоты, которые диссоциируют лишь частично, а не полностью, в водном растворе. Такие кислоты образуют составные реакции, и их ионы водорода составляют всего лишь несколько процентов от начального количества ионов. Примерами слабых кислот могут служить уксусная или угольная кислоты. Реакция между слабой кислотой и водой происходит в направлении равновесия, и константа равновесия выражает степень диссоциации.
Определение кислоты и ее свойства
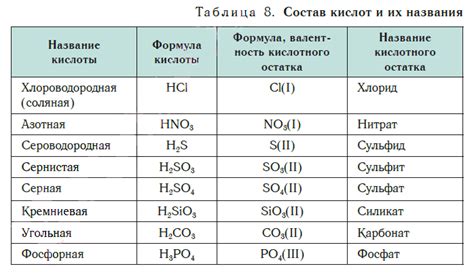
Сильные кислоты обладают высокой степенью диссоциации в воде. Это означает, что они полностью расщепляются на ионы водорода и анионы. Примерами сильных кислот являются серная (H2SO4), соляная (HCl) и азотная (HNO3) кислоты.
Слабые кислоты, напротив, диссоциируют только частично в воде. Это означает, что только небольшая часть молекул кислоты отдает протоны, а большая часть остается в неизменном состоянии. Примеры слабых кислот включают уксусную (CH3COOH), угольную (H2CO3) и фосфорную (H3PO4) кислоты.
Свойства кислот могут быть определены через их реакцию с основаниями, металлами и другими веществами. Кислоты реагируют с основаниями, образуя соль и воду в процессе нейтрализации. С растворами металлов они взаимодействуют, выделяя водород и образуя металлические соли. Они также способны коррозировать металлы и разрушать органические материалы.
Кроме того, кислоты обладают кислотно-щелочным индикатором, изменяя цвет при добавлении щелочи или кислоты. Они имеют кислый вкус и запах, и могут вызывать раздражение при контакте с кожей и слизистыми.
| Силовой критерий | Сильные кислоты | Слабые кислоты |
|---|---|---|
| Степень диссоциации в воде | Высокая | Низкая |
| Примеры | Серная кислота (H2SO4), соляная кислота (HCl), азотная кислота (HNO3) | Уксусная кислота (CH3COOH), угольная кислота (H2CO3), фосфорная кислота (H3PO4) |
| Реакция с основаниями | Нейтрализация, образование соли и воды | Нейтрализация, образование соли и воды |
| Реакция с металлами | Выделение водорода, образование металлических солей | Выделение водорода, образование металлических солей |
| Кислотно-щелочной индикатор | Изменение цвета при добавлении щелочи | Изменение цвета при добавлении щелочи |
Сильные кислоты: особенности и свойства
Основными свойствами сильных кислот являются:
| Свойство | Описание |
|---|---|
| Высокая электроотрицательность | Сильные кислоты обладают высокой электроотрицательностью, что обусловлено большим разностью электроотрицательностей атомов водорода и кислорода в молекуле. |
| Низкий рН | Поскольку сильные кислоты полностью диссоциируют в водном растворе, они обладают низким значением рН (менее 2). |
| Сильная способность отдавать протоны | Сильные кислоты обладают высокой способностью отдавать протоны и реагировать с щелочными соединениями, образуя соль и воду. |
| Высокая степень диссоциации | Водные растворы сильных кислот полностью ионизируются, образуя ионы водорода (H+) и концентрация которых является равной начальной концентрации кислоты. |
Примерами сильных кислот являются соляная кислота (HCl), солянка кислота (HNO3) и серная кислота (H2SO4). Они широко используются в промышленности и лабораторной практике благодаря своим реакционным и окислительным свойствам.
Важно отметить, что сильные кислоты могут быть опасными для человека и окружающей среды. При работе с ними необходимо соблюдать меры безопасности и использовать личную защиту.
Слабые кислоты: основные характеристики
1. Низкая степень диссоциации: При растворении слабых кислот в воде происходит небольшая ионизация, что приводит к образованию ограниченного количества ионов в растворе.
2. Недостаточная проводимость: Из-за низкой ионизации слабые кислоты имеют невысокую электропроводность, что отличает их от сильных кислот.
3. Нейтральные молекулы: В отличие от сильных кислот, слабые кислоты большую часть времени находятся в виде нейтральных молекул, не проявляя свойства кислоты.
4. Кислотное равновесие: Ионизация слабых кислот происходит по принципу обратимой реакции, что приводит к установлению кислотного равновесия в растворе.
5. Константа диссоциации: Слабые кислоты обладают константой диссоциации (Ka), характеризующей их способность отдавать протоны в растворе и определяемая уравнением равновесия и их концентрацией.
6. Реакция сильных кислот: Взаимодействие слабой кислоты со сильной кислотой приводит к образованию более сильной кислоты и слабой основы.
Критерии определения крепости кислоты
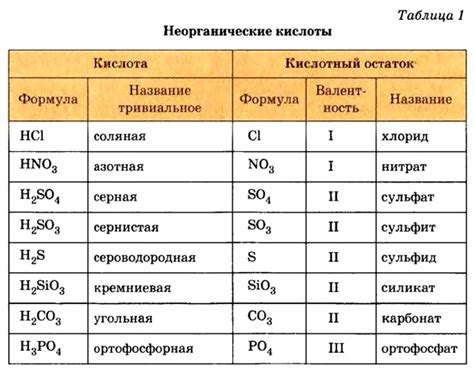
Крепость кислоты характеризует ее способность отдавать протоны в растворе. Чем больше протонов отдается кислотой, тем крепче она считается.
Существует ряд критериев, по которым можно определить крепость кислоты. Один из таких критериев - степень ионизации кислоты в водном растворе. Чем больше кислотных молекул ионизируется, тем крепче кислота.
Другим критерием является константа ионизации кислоты (Ka). Эта константа показывает, насколько полное ионизирование происходит при данной концентрации кислоты. Чем больше значение Ka, тем сильнее кислота.
Также, можно определить крепость кислоты по реакции с щелочью. Если кислота полностью реагирует с щелочью, то она считается сильной. Если реакция происходит слабо или вообще не происходит, то кислоту можно назвать слабой.
Необходимо отметить, что крепость кислоты влияет на ее химические свойства и способность взаимодействовать с другими веществами. Сильные кислоты обычно обладают высокой активностью и реагируют с большим количеством соединений. Слабые кислоты зачастую не образуют стабильных ионов и проявляют меньшую активность.
Важность реакции кислот

Одним из важных аспектов реакций кислот является их способность отдавать протоны в реакциях с другими веществами. Критерии, которые определяют, насколько сильной или слабой является кислота, включают концентрацию и реакционную способность кислоты.
Сильные кислоты характеризуются высокой концентрацией протонов и способностью отдавать их с легкостью. Они обычно образуют множество реакций с другими веществами и могут вызывать ощутимые изменения при контакте с ними. Сильные кислоты, такие как серная и хлористоводородная кислоты, используются в промышленности для производства различных продуктов и материалов.
Слабые кислоты, с другой стороны, имеют более низкую концентрацию протонов и обычно менее реакционно способны. Их реакции с другими веществами могут быть менее сильными и могут происходить медленнее. В сельском хозяйстве и пищевой промышленности слабые кислоты, такие как лимонная и молочная кислоты, часто используются для придания вкуса и консервации продуктов.
Понимание критериев, определяющих силу и слабость кислот, является важным для химиков и научных исследователей, чтобы эффективно использовать кислоты во многих сферах жизни. Кроме того, знание реакций кислот позволяет нам понять процессы, происходящие в нашем организме и регулировать их с помощью диеты и лекарств.
Реакция кислот с различными веществами

Реакция кислот с различными веществами зависит от их химических свойств и степени активности кислоты. Сильные кислоты, такие как серная или хлороводородная кислоты, способны проявлять сильные реакции с различными веществами.
Когда сильная кислота взаимодействует с металлами, они образуют соли и выделяются водород. Это реакция образования солей, которая может происходить с различной интенсивностью в зависимости от активности металла.
Кроме того, сильные кислоты могут способствовать диссоциации воды, образуя ионы водорода (H+) и гидроксидные ионы (OH-) в растворе. Это может привести к образованию кислотно-щелочного баланса и изменению pH вещества.
Слабые кислоты, такие как уксусная или лимонная кислоты, обычно проявляют менее интенсивные реакции с веществами. Они также могут образовывать соли с металлами, но доходит до этого реакция не всегда полностью. Кроме того, слабые кислоты могут проявлять взаимодействие с основаниями, образуя соли и воду.
Таким образом, реакция кислот с различными веществами зависит от их силы и свойств, а также от химической активности самих веществ. Это служит основой для понимания и изучения особенностей и поведения кислот в химических реакциях с различными соединениями.
Сравнение сильных и слабых кислот

Сильные кислоты, такие как HCl (соляная кислота) или H2SO4 (серная кислота), полностью расщепляются на ионы в водном растворе. Они имеют высокую силу и реагируют с веществами, обладающими высокими основными свойствами.
С другой стороны, слабые кислоты, такие как CH3COOH (уксусная кислота) или H2CO3 (угольная кислота), не полностью расщепляются на ионы в воде. Они имеют низкую силу и реагируют слабо с основными веществами. Это связано с меньшей степенью ионизации слабых кислот.
Кроме того, сильные кислоты имеют более низкий pH (кислотность) в растворе, в то время как слабые кислоты имеют близкий к нейтральному pH. Для сравнения, сильная кислота, такая как соляная кислота, имеет pH около 1, а уксусная кислота имеет pH около 3-4.
Сильные кислоты также проявляют высокую реакционную активность и способны быстро реагировать с другими веществами. Они могут вызывать коррозию и разрушение материалов, когда используются в высоких концентрациях. Слабые кислоты менее активны и могут быть безопасными для использования в некоторых приложениях.