Полимеразная цепная реакция (ПЦР) – это метод генетического анализа, который позволяет в несколько этапов увеличивать количество нужной ДНК в пробе. Этот метод является важным инструментом в современной биологии, медицине и научных исследованиях. Он позволяет определить наличие или отсутствие определенного генетического материала в образце, возможность разработки ПЦР в домашних условиях была значительным предложениемустремлений.
Хотя ПЦР обычно оказалсясложный, специализированный процесс, существуютзначительные успехи в разработке простыхметодовПЦР в домашних условиях. В этой статье мы предоставим пошаговую инструкцию, которая поможет вам создать ПЦРв домашних условиях без необходимости оборудования лаборатории.
Шаг 1: Соберите необходимые материалы. Выполнение ПЦР в домашних условиях потребует следующих компонентов: образец ДНК, праймеры (короткие фрагменты ДНК, которые помогут определить нужный генетический материал), реагенты для ПЦР (такие как Таq полимераза, дезоксирибонуклеотидтрифосфаты (dNTP) и буфер ПЦР), термостат (для поддержания температурных режимов), термостабильные трубки и пипетки для точных измерений.
Шаг 2: Подготовьте реакционную смесь. Смешайтеколичество раствора ПЦР, дезоксирибонуклеотидтрифосфаты (dNTP) и Таq полимеразу в соответствii с протоколом реакции. Добавьте праймеры, которые соответствуют генетическому материалу, который вы хотите определить. Не забудьте добавить образец ДНК, который будет анализироваться.
Шаг 3: Проведите циклы ПЦР. Разместите реакционную смесь в термоциклере, который будет обеспечивать нужные температуры и временные параметры для проведения ПЦР. Циклы ПЦР включают нагревание смеси до определенной температуры, чтобы разделить двойную спираль ДНК, охлаждение для связывания праймеров с шаблонной ДНК и повторяющиеся циклы нагревания и охлаждения, чтобы удлинить (амплифицировать) нужную ДНК.
Шаг 4: Проверьте результаты. После окончания циклов ПЦР изучите результаты. Используйте гелевую электрофорез, чтобы разделить и визуализировать продукты ПЦР. Если ваша цель состоит в определении присутствия или отсутствия определенного генетического материала, интерпретируйте результаты в соответствии с этой целью.
Используя эту пошаговую инструкцию, вы можете попробовать провести ПЦР в домашних условиях. Помните, что результаты, полученные в домашних условиях, могут быть менее точными и непредсказуемыми, чем результаты, полученные в лаборатории со специализированным оборудованием. Однако, в домашних условиях можно получить базовое представление о том, как проводить ПЦР и проникнуть в эти методы анализа на новом уровне.
Подготовка к ПЦР
Прежде чем приступить к проведению ПЦР-анализа в домашних условиях, необходимо убедиться, что у вас есть все необходимые материалы и оборудование. Вот список того, что вам понадобится:
- Набор для ПЦР
- Термоциклер
- Генератор белого шума (опционально)
- Минилаборатория (опционально)
Проверьте, есть ли у вас все компоненты набора для ПЦР, включая ферменты, пробирки, примеси и реактивы. Убедитесь, что срок годности всех реагентов не истек.
Место проведения ПЦР-анализа должно быть чистым, лишенным посторонних запахов и загрязнений. Рекомендуется проводить анализ в специальной минилаборатории, но если у вас ее нет, то любая хорошо вентилируемая комната подойдет.
Перед началом работы пошлите генератор белого шума включенным на несколько минут, чтобы создать условия стерильности и избавиться от возможных частиц, мешающих проведению анализа.
Отбор биоматериала для ПЦР-анализа
Выбор биоматериала
Для ПЦР-анализа можно использовать различные типы биоматериала в зависимости от исследуемой проблемы. Наиболее распространенным биоматериалом для ПЦР-анализа является кровь, а именно:
- Венозная кровь, собранная в пробирку с антикоагулянтом. Этот тип биоматериала позволяет извлекать ДНК для ПЦР-анализа, а также проводить квантификацию РНК с использованием протоколов экстракции.
- Капиллярная кровь, собранная с помощью пальца или пяточка. Этот метод сбора биоматериала используется для анализа генетических мутаций или при скрининге на хромосомные аномалии.
Кроме крови, для ПЦР-анализа можно использовать и другие типы биоматериала:
- Слюна (смыв от слизистых оболочек полости рта). Этот вид биоматериала используется при генетическом анализе, исследовании наличия наследственных заболеваний и определении идентичности личности.
- Различные биологические выделения (например, слезы, спинномозговая жидкость, сумка Дугласа). Использование этих типов биоматериалов требует специализированной обработки и подготовки.
Сбор биоматериала
Правильный сбор биоматериала – это важный этап предварительной подготовки для ПЦР-анализа. Во избежание контаминации микроорганизмами или потери ДНК/РНК, следуйте этим основным рекомендациям:
- Дезинфицируйте руки и используйте индивидуальные защитные перчатки, чтобы предотвратить загрязнение образца.
- Используйте специальные контейнеры для сбора биоматериала, предназначенные для ПЦР-анализа.
- Убедитесь, что контейнеры чистые и не имеют следов предыдущего использования, чтобы избежать попадания посторонних ДНК/РНК.
- Правильно маркируйте контейнеры с обозначением типа биоматериала и даты сбора.
- Следуйте инструкциям процедуры сбора биоматериала, чтобы получить наиболее точные и надежные результаты.
При сборе биоматериала важно соблюдать особую чистоту и аккуратность, чтобы избежать любого контакта с возбудителями других инфекционных заболеваний. На каждом этапе следует минимизировать возможность загрязнения и механических повреждений образцов, предотвращая некорректные результаты ПЦР-анализа.
Правильно собранный биоматериал - залог успешного ПЦР-анализа. Следование инструкциям по сбору и хранению образцов поможет получить точные и достоверные результаты исследования.
Подготовка реакционной смеси
Перед тем как начать процедуру полимеразной цепной реакции (PCR), необходимо правильно подготовить реакционную смесь. Этот этап играет ключевую роль в успешном проведении анализа. В данном разделе мы рассмотрим пошаговую инструкцию по подготовке реакционной смеси.
Шаг 1: Взвесьте необходимое количество компонентов смеси, таких как дезоксирибонуклеозидтрифосфаты (dNTP), реагенты для термостабилизации, фермент ДНК-полимераза, примеси, и другие добавки. Подготовьте рабочие растворы каждого компонента, согласно указаниям производителя.
Шаг 2: Сделайте предварительную проверку качества всех реагентов и их совместимости. Убедитесь, что срок годности не истек, и проведите контрольные тесты, чтобы исключить наличие загрязнений или ненужных примесей.
Шаг 3: Подготовьте реакционные пробы для каждого образца, которые будут содержать ДНК-матрицу, праймеры и добавки. Обязательно используйте стерильные инструменты и чистые пробы, чтобы избежать контаминации.
Шаг 4: Разморозьте или разведите образцы ДНК до необходимой концентрации с использованием стерильного буфера или дистиллированной воды. Убедитесь, что образцы хранятся при низкой температуре и не подвергались повторным заморозкам.
Шаг 5: Подготовьте рабочие пробы согласно протоколу PCR. Добавьте в каждую пробу соответствующие объемы каждого компонента реакционной смеси, следуя указаниям производителя или рекомендациям протокола.
Шаг 6: Тщательно перемешайте содержимое каждой пробы, чтобы обеспечить равномерное распределение всех компонентов. Для этого можно использовать пипетку или вортекс.
Шаг 7: Предоставьте достаточное время для реагирования компонентов реакционной смеси. Обычно это занимает около 10-20 минут. Затем реакционная смесь готова для проведения ПЦР.
Обратите внимание, что точный протокол подготовки реакционной смеси может варьироваться в зависимости от используемых реагентов, образцов и целей проводимого исследования. Всегда следуйте инструкциям производителя и рекомендациям протокола, чтобы получить наилучшие результаты.
Нанесение реакционной смеси на ПЦС-склейки
После того как ПЦС-склейки были подготовлены и тщательно обезжирены, можно начинать нанесение реакционной смеси.
Сначала приготовьте нужное количество реакционной смеси в соответствии с рецептом, следуя указаниям производителя. Обычно это смесь из праймеров, дезоксирибонуклеотидного трифосфата (dNTP), фермента Таq ДНК-полимеразы и буферов.
Затем, с помощью пипетки, осторожно добавьте реакционную смесь на поверхность каждой ПЦС-склейки. При этом старайтесь избегать образования пузырьков и контакта с краями склейки, чтобы избежать её загрязнения.
После того как реакционная смесь была добавлена, закройте каждую ПЦС-склейку крышкой и аккуратно перенесите их в термоциклер.
Запустите программу амплификации, которая была заранее разработана для вашего эксперимента, и ожидайте окончания циклов амплификации.
Готовые ПЦС-склейки можно хранить в холодильнике до использования или сразу приступить к анализу полученных продуктов ПЦР.
Необходимо помнить, что все манипуляции с реакционной смесью и ПЦС-склейками следует производить в условиях чистоты и стерильности, чтобы избежать загрязнения образцов и получить надежные результаты амплификации.
Настройка ПЦР-аппарата

Вот пошаговая инструкция о том, как настроить ПЦР-аппарат:
Шаг 1: Проверьте, чтобы ПЦР-аппарат был подключен к электрической сети и находился в рабочем состоянии.
Шаг 2: Установите термоблок ПЦР-аппарата в соответствии с режимом амплификации, указанным в протоколе ПЦР.
Шаг 3: Проверьте, чтобы в термоблоке не было посторонних предметов или загрязнений.
Шаг 4: Установите крышку на термоблок и убедитесь в надежности ее крепления.
Шаг 5: Включите ПЦР-аппарат и дождитесь, пока система проходит инициализацию и достигает рабочей температуры.
Шаг 6: Проверьте калибровку термометра в термоблоке и, при необходимости, скорректируйте его показания.
Шаг 7: Установите необходимые программные параметры ПЦР-анализа, включая температурные условия и время проведения каждого этапа амплификации.
Шаг 8: Проверьте, чтобы все реагенты и расходные материалы были готовы к использованию, и убедитесь в правильности их маркировки.
Шаг 9: Проверьте наличие и правильность последовательности всех необходимых этапов амплификации в программе ПЦР-анализа.
После выполнения всех этих шагов ПЦР-аппарат будет готов к проведению ПЦР-анализа с использованием выбранного протокола и реагентов.
Циклы амплификации в ПЦР
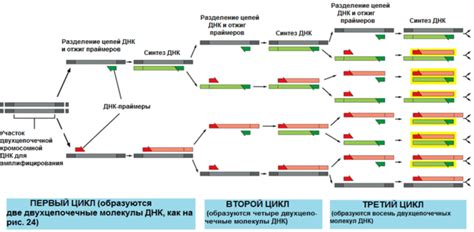
Полимеразная цепная реакция (ПЦР) представляет собой метод для копирования конкретного участка ДНК в большом количестве. Этот процесс состоит из нескольких циклов амплификации, каждый из которых включает три этапа: денатурацию, отжиг и элонгацию.
1. Денатурация. В этом этапе двухцепочечная ДНК разделяется на две отдельные цепи. Температура понижается до около 95 ° C, чтобы разрушить водородные связи между комплементарными нуклеотидами и разделить цепочки.
2. Отжиг. После денатурации температура повышается до примерно 50-65 ° C, чтобы привязанные к матричной нитью праймеры могли связаться с комплементарными регионами ДНК. Они служат начальными точками для продолжения синтеза новой цепи.
3. Элонгация. Температура повышается до около 72 ° C, что является оптимальной температурой работы ДНК-полимеразы. Она присоединяется к последовательности праймера и начинает синтез новой цепи ДНК на основе матричной цепи. Новая цепь полимеразы идет вдоль матричной цепи, продлевая ее.
После первого цикла амплификации, получившиеся две новые цепи ДНК могут служить новой матрицей для следующего цикла. Циклы амплификации продолжаются до достижения нужного количества копий целевого ДНК.
| Цикл амплификации | Температура | Длительность |
|---|---|---|
| Денатурация | 95 °C | 30 сек |
| Отжиг | 50-65 °C | 30 сек |
| Элонгация | 72 °C | 30 сек на 1 кб ДНК |
Анализ результатов ПЦР

Для проведения агарозного гель-электрофореза необходимо приготовить агарозный гель, который является основой для разделения фрагментов ДНК. Готовый гель помещается в электрофорезную камеру, в которую добавляется буфер электрофореза. Затем в каждый угол камеры наносятся образцы ДНК, полученные после ПЦР.
После запуска электрофореза и применения электрического тока образцы ДНК мигрируют через агарозный гель. Маленькие фрагменты ДНК мигрируют быстрее и приходят к концу геля первыми, в то время как большие фрагменты мигрируют медленнее. Таким образом, агарозный гель-электрофорез позволяет разделить полученные фрагменты ДНК по их размеру.
После окончания электрофореза, гель окрашивают специальным красителем, который связывается с ДНК и делает ее видимой. Полученные полосы можно сфотографировать или проанализировать при помощи специального анализатора, который позволяет измерить размеры фрагментов ДНК.
Анализ результатов ПЦР с использованием метода агарозного гель-электрофореза является важным этапом в проведении исследований в генетике и молекулярной биологии. Точный и надежный анализ результатов позволяет получить ценные данные о генетическом материале и применить их в различных областях медицины, науки и промышленности.
Интерпретация результатов ПЦР

Для интерпретации результатов ПЦР используется агарозный гель-электрофорез. Этот метод позволяет разделить участки ДНК и РНК по их размеру и идентифицировать амплифицированный фрагмент с помощью окрашивания.
При правильной амплификации целевого участка в пробе появляется полоска на геле. Она может быть и интенсивной, и слабой, в зависимости от количества амплифицированной ДНК или РНК. Если полоска отсутствует, это может свидетельствовать о недостаточном количестве исходного материала или о неудачной реакции ПЦР.
Кроме того, результаты ПЦР могут быть квалифицированы как "положительные" или "отрицательные". Положительный результат означает, что амплификация произошла, и целевой участок был обнаружен в образце. Отрицательный результат указывает на отсутствие амплификации и, следовательно, отсутствие целевого участка.
Однако интерпретация результатов ПЦР требует достаточных знаний и опыта, поэтому рекомендуется обращаться к профессионалам в лаборатории для получения точной диагностики и результата. В самостоятельной интерпретации результатов всегда существует риск ошибки.
| Результат | Интерпретация |
|---|---|
| Положительный | Амплификация произошла, целевой участок обнаружен |
| Отрицательный | Отсутствие амплификации, целевой участок отсутствует |