Вторичная структура белка – это уникальное сочетание множества связей между аминокислотами, которые обеспечивают его устойчивость и функциональность. Одним из основных типов вторичной структуры является пептидная спираль, или альфа-спираль. Она образуется благодаря водородным связям между аминокислотами, которые содействуют формированию спиральной конформации.
Водородные связи оказывают значительное влияние на устойчивость вторичной структуры и позволяют пептидам образовывать стабильные пространственные конформации. Эти связи возникают между атомами водорода и атомами кислорода или азота в основных цепях аминокислот. В результате образуются массивные цепочки водородных связей, которые сжимают пептидную спираль и предотвращают ее разворот.
Кроме водородных связей, вторичную структуру белка усиливают также другие типы связей, такие как ионо-дипольные и гидрофобные взаимодействия. Ионо-дипольные связи возникают между заряженными группами аминокислот и молекулами воды. Гидрофобные взаимодействия происходят между гидрофобными остатками аминокислот, к которым молекулы воды не образуют водородные связи и избегают контакта с ними.
Вторичная структура белка и ее устойчивость
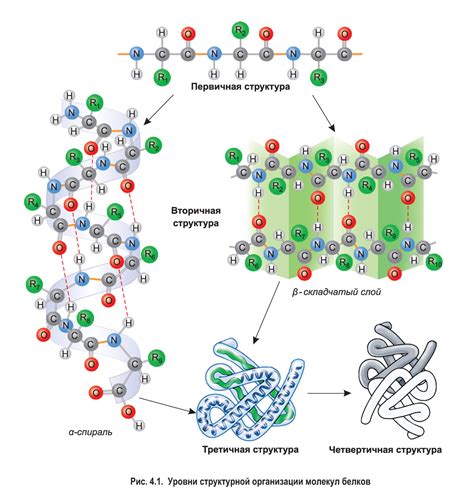
Вторичная структура белков формируется за счет образования различных связей и взаимодействий между аминокислотными остатками. Основными элементами вторичной структуры являются α-спирали, β-складки и β-повороты. Они образуются благодаря водородным связям между аминокислотными остатками.
Водородные связи являются силами взаимодействия, которые обеспечивают устойчивость и прочность вторичной структуры белка. Они образуются между атомом водорода, принадлежащим аминогруппе одной аминокислоты, и атомом кислорода, принадлежащим карбоксилной группе другой аминокислоты.
Помимо водородных связей, вторичная структура белка может также устанавливать другие виды связей, такие как гидрофобные взаимодействия, ионные связи и дисульфидные мостики. Эти связи усиливают стабильность вторичной структуры и способствуют ее сохранению.
| Виды связей | Описание |
|---|---|
| Водородные связи | Силы взаимодействия между атомом водорода и атомом кислорода |
| Гидрофобные взаимодействия | Взаимодействия между гидрофобными аминокислотами |
| Ионные связи | Взаимодействия между заряженными аминокислотами |
| Дисульфидные мостики | Связи, образуемые между двумя цистеинами |
Вторичная структура белка играет важную роль в его функционировании, поскольку определяет его форму и свойства. Устойчивость вторичной структуры обеспечивает стабильность белка и позволяет ему исполнять свои функции. Изучение связей и взаимодействий, формирующих вторичную структуру, помогает понять механизм стабилизации белков и разработать новые методы модификации и создания искусственных белков с заданными свойствами.
Роль связей в стабилизации пептидов

Пептиды играют важную роль в живых организмах, выполняя функции структурных элементов, сигнальных молекул и ферментов. Однако, чтобы пептиды могли выполнять свои функции, они должны быть стабильными и не разрушаться высокими температурами или изменением pH.
Одним из ключевых факторов, обеспечивающих стабильность пептидов, являются связи, образующиеся между аминокислотными остатками. Эти связи могут быть ковалентными или нековалентными.
Ковалентные связи включают в себя пептидные связи, которые образуются между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты. Эти связи образуют основу вторичной структуры белка - α-спираль, β-складку или спиралевидные структуры.
Нековалентные связи включают в себя водородные связи, ионные взаимодействия, гидрофобные взаимодействия и ван-дер-ваальсовы силы. Они слабее ковалентных связей, но все же играют важную роль в стабилизации пептидов.
Vodформирование водородных связей между аминокислотными остатками пептида способствует созданию устойчивой трехмерной структуры. Ионные взаимодействия возникают между положительно и отрицательно заряженными остатками аминокислот. Гидрофобные взаимодействия обусловлены стремлением гидрофобных остатков образовать группу в центре молекулы.
Ван-дер-ваальсовы силы являются слабыми притяжениями, обусловленными изменениями зарядов молекул в течение времени. Они могут быть слабыми, но вместе с остальными связями увеличивают структурную устойчивость пептидов.
Таким образом, связи между аминокислотными остатками играют важную роль в обеспечении устойчивости и стабильности пептидов. Без этих связей пептиды разрушились бы, и не смогли выполнять свою функцию в организмах.
Факторы, влияющие на устойчивость вторичной структуры

Стабильность вторичной структуры белка определяется несколькими факторами, которые взаимодействуют между собой для обеспечения прочности и стабильности.
- Гидрофобные взаимодействия: негидрофильные аминокислоты, такие как аспарагин, глутамин, гистидин, цистеин и пролин, образуют гидрофобные контакты между собой, что способствует образованию стабильной структуры.
- Водородные связи: аминокислоты образуют водородные связи между группировками атомов водорода и кислорода, что укрепляет вторичную структуру.
- Электростатические взаимодействия: положительно и отрицательно заряженные аминокислоты образуют электростатические связи между собой, что способствует установлению стабильной вторичной структуры.
- Гибкость и жесткость пептидной цепи: пептидная цепь может быть гибкой или жесткой в зависимости от конформации. Жесткая конформация способствует образованию вторичной структуры.
- Силы осаждения: факторы, такие как соль, pH и температура, могут влиять на устойчивость вторичной структуры путем изменения заряда аминокислот и прочности связей.
Все эти факторы работают вместе, обеспечивая стабильность вторичной структуры белка и его способность выполнять свою функцию в организме.



