Определение концентрации раствора является одной из важных задач в химии и физике. В современном мире концентрация растворов широко используется в различных областях науки и промышленности, и ее точное определение имеет большое значение. Основываясь на математике и применяя определенные формулы, можно определить концентрацию раствора с высокой точностью.
Концентрация раствора - это величина, которая измеряет количество растворенного вещества в единице объема раствора. Она может быть выражена различными способами, включая процентное содержание, молярность, нормальность и т. д. Определение концентрации раствора в математике основано на различных формулах и уравнениях, которые позволяют вычислить ее значения.
Один из способов определения концентрации раствора в математике - использование формулы C = m/V, где С - концентрация раствора, m - масса растворенного вещества, V - объем раствора. Также можно использовать формулы, связывающие концентрацию раствора с другими физическими величинами, например, с молярной массой или с молярным объемом.
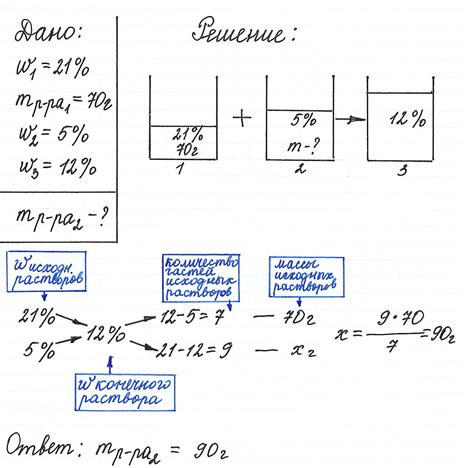
Как вычислить концентрацию раствора?

Для вычисления концентрации раствора необходимо знать массу растворенного вещества и объем раствора.
Концентрация раствора может быть выражена в различных единицах измерения, таких как проценты (%), молярность (моль/л), нормальность (экв/л) и др.
Одним из способов вычисления концентрации является вычисление массовой доли растворенного вещества:
Массовая доля (%) = (масса растворенного вещества / общая масса раствора) * 100%
Другим способом является вычисление молярности раствора:
Молярность (моль/л) = (количество вещества растворенного вещества) / (объем раствора в литрах)
Также можно вычислить нормальность раствора, если известно уравнение реакции, протекающей в растворе:
Нормальность (экв/л) = (количество эквивалентов растворенного вещества) / (объем раствора в литрах)
В зависимости от требуемой точности и необходимых единиц измерения, можно выбрать наиболее подходящий способ вычисления концентрации раствора.
Важно помнить, что для точного определения концентрации раствора необходимо производить измерения с использованием точных приборов и следовать правилам химической лабораторной практики.
Определение концентрации раствора
Концентрацию раствора обычно обозначают символом С и записывают в виде С = m/V, где С – концентрация раствора, m – масса растворенного вещества, V – объем растворителя.
Для определения концентрации раствора можно использовать различные методы, в зависимости от физических и химических свойств растворенного вещества и растворителя. Некоторые из распространенных методов включают гравиметрический метод, вольтамперометрию, спектрофотометрию и титрование.
- Гравиметрический метод основан на определении массы растворенного вещества путем отделения его от растворителя и последующего взвешивания.
- Вольтамперометрия измеряет ток, проходящий через раствор, и позволяет вычислить концентрацию ионов.
- Спектрофотометрия использует поглощение света раствором для определения концентрации вещества.
- Титрование – это химическая реакция, при которой известное количество реактива используется для измерения концентрации другого вещества.
Определение концентрации раствора является важным шагом во многих химических и физических анализах. Точное знание концентрации позволяет контролировать реакции, проводить расчеты и достигать необходимых результатов в различных областях науки и промышленности.
Концентрация раствора: массовая или объемная?

Существуют два основных способа измерения концентрации раствора: массовый и объемный. Массовая концентрация выражается в граммах растворенного вещества на литр растворителя. Такая концентрация обычно обозначается как "г/л" или "г/дм³". Массовая концентрация широко используется в химической аналитике и применяется для измерения содержания вещества в растворе.
Объемная концентрация, с другой стороны, выражается в литрах растворенного вещества на литр раствора. Такая концентрация обычно обозначается как "л/л" или "л/дм³". Объемная концентрация особенно полезна в контексте растворов с несколькими компонентами, где общий объем раствора может меняться.
Выбор между массовой и объемной концентрацией зависит от специфической характеристики исследования или применения раствора. Например, для измерения массы растворенного вещества в определенном объеме растворителя, более подходящей будет массовая концентрация. С другой стороны, если необходимо знать, сколько объема раствора содержит определенное количество вещества, то следует использовать объемную концентрацию.
Массовая и объемная концентрации предоставляют информацию о различных физических свойствах раствора и позволяют уточнить и анализировать его состав. Правильный выбор способа измерения концентрации раствора помогает проводить точные и надежные эксперименты и обеспечивает более полное понимание его химической природы.
Массовая концентрация раствора

Для расчета массовой концентрации раствора необходимо знать массу растворенного вещества и объем растворителя. Формула для расчета массовой концентрации выглядит следующим образом:
Массовая концентрация (С) = (масса растворенного вещества / объем растворителя)
Единицы измерения массовой концентрации зависят от системы единиц, используемой в конкретной стране. В международной системе единиц (СИ) масса измеряется в граммах, а объем – в литрах. В разных странах могут использоваться разные системы единиц, поэтому необходимо учитывать это при проведении расчетов.
Например, если мы имеем раствор, в котором 20 граммов соли растворены в 1 литре воды, то массовая концентрация этого раствора будет равна 20 г/л.
Массовая концентрация раствора позволяет определить, насколько насыщенным является раствор веществом. Более высокая массовая концентрация указывает на более концентрированный раствор, в котором большое количество вещества содержится в небольшом объеме растворителя.
Объемная концентрация раствора

Чтобы определить объемную концентрацию раствора, нужно знать массу растворенного вещества и объем раствора. Формула для расчета объемной концентрации следующая:
C = m/V,
где C - объемная концентрация (л/м³ или моль/л), m - масса растворенного вещества (в граммах или молях), V - объем раствора (в литрах).
Например, если в 1 литре раствора содержится 100 грамм соли, то объемная концентрация раствора соли будет равна 100 г/л.
Объемная концентрация раствора является одним из важных параметров химических реакций и используется для определения количества вещества в растворе. Она также помогает оценить степень насыщенности раствора и проводить расчеты при приготовлении растворов.
Как вычислить массовую концентрацию раствора?

Для вычисления массовой концентрации раствора необходимо знать массу растворенного вещества и объем раствора. Формула для вычисления массовой концентрации выглядит следующим образом:
Массовая концентрация = (масса растворенного вещества / объем раствора) * 100%
Процесс вычисления массовой концентрации можно разделить на следующие шаги:
- Измерьте массу растворенного вещества в граммах. Эта информация может быть указана на упаковке или получена с помощью весов.
- Измерьте объем раствора в литрах. Объем можно измерить с помощью мерной колбы или цилиндра.
- Примените формулу для вычисления массовой концентрации, разделив массу растворенного вещества на объем раствора и умножив результат на 100%.
Полученное значение массовой концентрации раствора будет выражено в процентах. Например, если масса растворенного вещества составляет 50 г, а объем раствора равен 1 л, то массовая концентрация раствора будет равна 50%.
Учет массовой концентрации раствора позволяет более точно контролировать концентрацию растворов, что является важным в химических экспериментах и промышленных процессах.
Как определить объемную концентрацию раствора?

Для определения объемной концентрации раствора необходимо знать массу растворенного вещества и объем раствора. Формула для расчета объемной концентрации выглядит следующим образом:
C = m/V
где:
C – объемная концентрация раствора;
m – масса растворенного вещества;
V – объем раствора.
Для того чтобы определить объемную концентрацию, нужно сначала измерить массу растворенного вещества с помощью весов и запомнить эту величину. Затем измерить объем раствора с помощью мерного сосуда.
Подставив измеренные значения в формулу, можно рассчитать объемную концентрацию раствора. Полученное значение будет показывать, сколько граммов вещества содержится в одном литре раствора.
Использование плотности для расчета концентрации

Для использования плотности (ρ) в расчете концентрации раствора (с), нужно знать молекулярную или атомную массу вещества (M) и плотность (ρ) самой смеси. Формула для расчета концентрации по плотности:
c = (ρ * 1000) / M
где:
- c - концентрация раствора (в моль/л)
- ρ - плотность раствора (в г/мл или кг/л)
- M - молекулярная или атомная масса вещества (в г/моль или а.е.м.)
Результатом этой формулы будет концентрация раствора в моль/л.
Примером использования плотности для расчета концентрации может служить раствор сахара в воде. Если известна плотность раствора и молекулярная масса сахара, можно определить его концентрацию.
Как использовать процентную концентрацию раствора?

Процентная концентрация раствора используется для определения количества растворенного вещества в данном растворе. Это важная величина, которая показывает, насколько насыщен раствор данным веществом.
Для использования процентной концентрации раствора необходимо знать массу растворенного вещества и объем раствора. По этим данным можно определить процентное содержание вещества в растворе.
Формула расчета процентной концентрации раствора:
C (%) = (m/v) * 100
где C - концентрация раствора в процентах, m - масса растворенного вещества, v - объем раствора.
Пример использования процентной концентрации раствора:
- Измерьте массу растворенного вещества. Например, масса соли составляет 20 г.
- Измерьте объем раствора. Например, объем воды составляет 100 мл.
- Подставьте известные значения в формулу: C (%) = (20 г / 100 мл) * 100 = 20%.
Таким образом, процентная концентрация раствора соли составляет 20%. Эта информация может быть полезна в химических и биологических исследованиях, а также в промышленности.
Примеры использования концентрации раствора

1. Подготовка буферных растворов: Буферные растворы используются для поддержания постоянного pH в химических реакциях и биологических системах. Концентрация раствора влияет на эффективность буферной системы и ее способность поддерживать стабильный pH.
2. Определение массы вещества в растворе: Концентрация раствора может использоваться для определения массы вещества, растворенного в данном объеме растворителя. Например, при изучении растворимости вещества можно определить, сколько граммов этого вещества содержится в 1 литре раствора.
3. Разведение растворов: Концентрация раствора может быть использована для разбавления растворов до нужной концентрации. Например, для приготовления 0,1 М раствора из 1 М раствора, необходимо разбавить исходный раствор водой с известным объемом и концентрацией.
4. Расчет теоретической концентрации реакционного продукта: Концентрация реакционного продукта может быть расчитана на основе концентрации реагентов и уравнения реакции. Это позволяет определить, какая масса или объем продукта будет образовываться при заданных условиях реакции.
Это лишь некоторые примеры, в которых концентрация раствора играет важную роль. Понимание и умение использовать концентрацию раствора позволяет проводить химические эксперименты и реакции более точно и предсказуемо.