Энергия связи атома - это важный параметр для изучения структуры и свойств материалов. Она представляет собой энергетическую величину, необходимую для разрыва связи между атомами в молекуле. Вычисление энергии связи может помочь исследователям понять, как атомы взаимодействуют и какие процессы происходят в химических реакциях и физических свойствах материалов.
В данном руководстве мы рассмотрим подробный алгоритм вычисления энергии связи атома в джоулях.
Шаг 1: Определение химической системы. Проанализируйте, какие атомы включены в состав вашей химической системы. Определите их вид, количество и их расположение между собой. Это важно, так как связи между атомами будут определяться их взаимной геометрией.
Шаг 2: Идентификация связей. Определите, между какими атомами существуют связи. Определите характер этих связей (ковалентные, ионные, металлические и т.д.) и их длину. Для этого можно использовать данные из литературных источников или результаты расчетов на основе эмпирических или квантовомеханических методов.
Шаг 3: Вычисление энергии связи. Для каждой связи вычислите ее энергию связи, используя известные энергетические зависимости для конкретного вида связи. Здесь может пригодиться использование квантовохимических программ, которые могут рассчитать энергии связей на основе квантовомеханических уравнений и приближений.
Это подробное руководство предоставит вам необходимые инструменты и шаги для вычисления энергии связи атома в джоулях. При правильном подходе и использовании достоверных данных, вы сможете получить точные значения и улучшить свои знания о химической структуре и свойствах материалов.
Определение понятия "энергия связи атома"
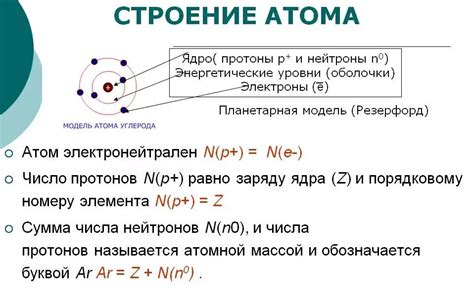
Взаимодействие атомов внутри молекулы или кристаллической решетки происходит благодаря обмену или передаче энергии, и энергия связи определяет, насколько сильно атомы притягиваются друг к другу.
Энергия связи атома может быть вычислена различными методами, в зависимости от типа системы и необходимой точности. Одним из наиболее распространенных и простых методов является вычисление энергии связи с использованием энергетических уровней атома и величины атомного радиуса.
Энергия связи атома играет важную роль во многих областях науки и технологий, таких как химия, физика, материаловедение и каталитические процессы. Понимание и умение вычислять ее способствуют разработке новых материалов, прогнозированию химических реакций и оптимизации процессов в различных отраслях промышленности.
Основные факторы, влияющие на энергию связи атома
Одним из основных факторов, влияющих на энергию связи, является электроотрицательность атомов, образующих связь. Электроотрицательность определяет способность атома притягивать электроны. Если атомы имеют различные электроотрицательности, то связь будет полярной, а энергия связи будет выше, чем при неполярной связи.
Также важным фактором является расстояние между атомами. Чем меньше расстояние между атомами, тем сильнее связь и, следовательно, выше энергия связи. Также, форма и геометрия молекулы могут влиять на энергию связи, поскольку они определяют взаимное положение атомов.
Другим фактором, влияющим на энергию связи атома, является парность связи. Различные молекулы могут иметь одну или более связей между атомами. Если молекула содержит двойную или тройную связь, энергия связи будет выше, чем при одиночной связи.
И, наконец, часто виртуальная энергия, связанная с сопротивлением атома к разрыву связи, влияет на энергию связи. Чем больше сопротивление, тем выше энергия связи.
| Факторы | Влияние на энергию связи |
|---|---|
| Электроотрицательность атомов | Полярная связь имеет большую энергию связи |
| Расстояние между атомами | Чем меньше расстояние, тем сильнее связь |
| Форма и геометрия молекулы | Могут влиять на взаимное положение атомов и энергию связи |
| Парность связи | Связи с двойными и тройными связями имеют большую энергию связи |
| Сопротивление к разрыву связи | Чем больше сопротивление, тем выше энергия связи |
Методы вычисления энергии связи атома

Для вычисления энергии связи атома можно использовать различные методы, которые базируются на разных аппроксимациях и моделях. Ниже перечислены некоторые из них:
| Метод | Описание |
|---|---|
| Метод полной оптимизации | В этом методе энергия связи атома вычисляется путем полной оптимизации расположения атомов в системе. Применяются математические алгоритмы, такие как метод градиентного спуска или метод Ньютона, для поиска минимума энергии системы. С помощью этого метода можно получить точные значения энергии связи атома, но он требует больших вычислительных ресурсов. |
| Метод конечных элементов | В этом методе система атомов разбивается на конечные элементы, и решается уравнение Шредингера для каждого элемента. Затем вычисляется общая энергия системы путем суммирования энергий каждого элемента. Метод конечных элементов позволяет учитывать геометрические особенности системы, такие как изогнутость или округленность атомов, что может быть важно при вычислении энергии связи. |
| Метод электронной плотности | В этом методе энергия связи атома вычисляется с использованием электронной плотности системы. Уравнение Шредингера решается для электронной плотности, и энергия связи атома определяется как энергия, связанная с взаимодействием атомных электронов с ядром атома. Метод электронной плотности обычно используется для моделирования крупных систем с большим количеством атомов. |
Выбор конкретного метода зависит от вида системы, которую нужно изучить, и требуемой точности вычисления энергии связи атома. Каждый из этих методов имеет свои особенности и ограничения, поэтому важно адаптировать их под конкретные условия и требования исследования.
Расчет энергии связи атома на основе электронной структуры

Одним из основных инструментов для расчета электронной структуры атома является метод Hartree-Fock. В его основе лежит приближение независимых электронов, которые движутся в потенциале ядра и электроны друг друга. Суть метода заключается в нахождении такой волновой функции, которая минимизирует энергию системы.
После нахождения волновой функции, можно приступить к расчету энергии связи атома. Для этого используется формула:
| Энергия связи = энергия атома - энергия изолированного ядра |
Энергия атома находится путем расчета суммы энергий всех электронов, находящихся в его электронной оболочке. Энергия изолированного ядра представляет собой энергию,
которая была бы в ядре с учетом энергии, выделенной на возникновение связи с остальными атомами.
Получив значения энергии атома и энергии изолированного ядра, можно произвести вычисление и получить итоговую энергию связи атома в джоулях.
Примеры практического вычисления энергии связи атома

Вычисление энергии связи атома может быть важным шагом в различных научных и технических исследованиях. Ниже приведены несколько примеров практического вычисления энергии связи атома.
Вычисление энергии связи водородного атома:
- Сначала необходимо определить массу ядра атома водорода и массу электрона.
- Далее, используя известные значения физических констант и уравнение Шрёдингера, вычислить энергию основного состояния водородного атома.
- Вычислить энергию связи атома, вычитая энергию основного состояния атома от энергии связи отдельного электрона и ядра.
Вычисление энергии связи атомов в молекуле:
- Измерить массу молекулы.
- Определить энергию основного состояния разомкнутых атомов, используя соответствующие физические модели и уравнение Шрёдингера.
- Вычислить энергию связи между атомами, вычитая энергию разомкнутых состояний от энергии основного состояния замкнутой системы.
Вычисление энергии связи в ионе:
- Измерить массу иона.
- Вычислить энергию основного состояния заряженной системы, применяя уравнение Шрёдингера и учитывая кулоновское взаимодействие.
- Определить энергию связи иона, вычитая энергию основного состояния иона от энергии связи разомкнутых частиц.
Приведенные примеры демонстрируют базовый подход к вычислению энергии связи атома в различных системах и могут быть использованы как отправная точка для более сложных задач. Результаты подобных вычислений позволяют понять характер связи между атомами и их энергетическое состояние, что имеет важное значение во многих областях науки и техники.
Использование формулы для расчета энергии связи атома

Для расчета энергии связи атома в джоулях необходимо использовать следующую формулу:
E = -13.6 * Z^2 / n^2
Здесь E - энергия связи, Z - заряд ядра атома, n - главное квантовое число.
Применение данной формулы позволяет определить энергию связи атома и оценить его стабильность. Чем меньше значение энергии связи, тем менее стабильным является атом.
Для расчета энергии связи можно использовать значения из периодической системы элементов. Заряд ядра атома (Z) и главное квантовое число (n) могут быть найдены в таблицах или обозначены для конкретного случая.
Расчет энергии связи атома в джоулях позволяет получить количественное значение этого параметра и сравнить его с другими атомами. Это также полезно для исследования и понимания химических связей и структуры атомов.
Практическое использование результатов вычислений энергии связи атома

Результаты вычисления энергии связи атома могут быть полезны во многих различных областях науки и технологии. Практическое использование этих данных позволяет получить ценную информацию о свойствах и поведении атомов в различных материалах и средах.
Одна из основных областей, где результаты вычислений энергии связи атома имеют практическое значение, - это изучение физических и химических процессов, связанных с взаимодействием атомов. Например, вычисленные значения энергии связи могут быть использованы для предсказания температурных изменений фазы или поведения материалов в различных экстремальных условиях.
Другой важной областью, где результаты вычислений энергии связи атома находят практическое применение, является разработка новых материалов и соединений. Зная энергию связи атомов, исследователи могут оптимизировать структуры материалов, улучшить их свойства и разработать новые материалы с желаемыми характеристиками, такими как прочность, упругость или проводимость.
Результаты вычислений энергии связи атома также могут быть использованы в медицине, например, для проектирования искусственных материалов или лекарств. Зная энергию связи между атомами, исследователи могут создавать более эффективные и безопасные лекарства или материалы для имплантатов.
Важно отметить, что результаты вычислений энергии связи атома имеют теоретическую природу и требуют подтверждения экспериментальными исследованиями. Однако, они являются мощным инструментом для понимания и прогнозирования свойств материалов и механизмов химических реакций.
В совокупности, практическое использование результатов вычислений энергии связи атома позволяет улучшить наше понимание мира вокруг нас и применить его для создания новых материалов, препаратов и технологий, что является важным вкладом в научное и технологическое развитие общества.