Удельная теплота сгорания – важная величина в физике, которая позволяет определить количество энергии, выделяющейся при сгорании единицы вещества. Она широко используется в различных областях науки, включая химию, термодинамику и энергетику.
Для того чтобы вычислить удельную теплоту сгорания, необходимо знать несколько параметров. Во-первых, это масса сгораемого вещества. Во-вторых, это количество получаемого тепла при сгорании этой массы вещества. И, наконец, необходимо учесть изменение температуры окружающей среды.
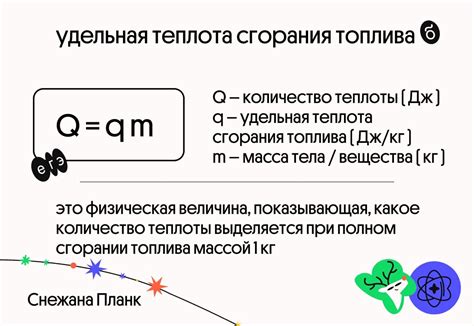
Для расчета удельной теплоты сгорания можно использовать формулу: Q = m∙c∙ΔT, где Q – количество тепла, m – масса сгораемого вещества, c – удельная теплоемкость вещества, ΔT – изменение температуры окружающей среды.
Пример вычисления удельной теплоты сгорания может быть следующим. Предположим, что мы хотим вычислить удельную теплоту сгорания алкоголя. Для этого сначала измерим массу алкоголя, затем сожжем его и измерим количество выделяющегося тепла. После этого, зная удельную теплоемкость алкоголя и изменение температуры окружающей среды, мы сможем вычислить удельную теплоту сгорания данного вещества.
Определение удельной теплоты сгорания

Удельная теплота сгорания (также известная как удельная теплота сгорания вещества) представляет собой количество теплоты, выделяющейся при полном сгорании единицы вещества. Однако, чтобы вычислить удельную теплоту сгорания, необходимо выполнить ряд экспериментальных измерений.
Для определения удельной теплоты сгорания можно использовать калориметр – специальное устройство, используемое для измерения количества выделяющейся или поглощаемой теплоты. В этом эксперименте необходимо измерить массу вещества, которое будет гореть, и затем сжечь его в самом калориметре.
Затем измеряется изменение температуры воды в калориметре после горения вещества. Используя закон сохранения энергии, можно вычислить количество теплоты, которое выделилось при горении. Для этого нужно учесть массу вещества и массу воды в калориметре, а также теплоемкость воды.
Подставив все известные значения в формулу:
| Q = | m | c | ΔT |
где Q - количество выделившейся теплоты, m - масса горящего вещества, c - теплоемкость воды, ΔT - изменение температуры, можно вычислить либо удельное значение теплоты сгорания, деля полученное значение на массу вещества, либо общую теплоту сгорания, умножив это значение на массу вещества.
Термодинамическая характеристика вещества
Одной из таких характеристик является удельная теплота сгорания. Удельная теплота сгорания определяет количество теплоты, выделяющейся при полном сгорании единицы массы вещества. Измеряется она в Дж/кг.
Для вычисления удельной теплоты сгорания необходимо учесть энергию, которая выделяется при взаимодействии вещества с кислородом в условиях постоянного давления и температуры.
Для вычисления удельной теплоты сгорания можно использовать формулу:
Q = ΔH / m
где Q - удельная теплота сгорания, ΔH - изменение энтальпии вещества при горении, m - масса сгораемого вещества.
Удельная теплота сгорания может быть полезна для решения различных задач, связанных с термодинамикой и энергетикой. Например, она позволяет рассчитать количество выделяющейся энергии при сжигании определенного вида топлива и использовать ее для генерации электроэнергии.
Как измеряется удельная теплота сгорания

Для измерения удельной теплоты сгорания чаще всего используют калориметр - прибор, предназначенный для точного измерения количества выделяющейся или поглощающейся теплоты. Калориметр состоит из изолированного контейнера, в котором происходит сгорание исследуемого вещества.
Во время эксперимента вещество сжигается в калориметре, корректно измеренное количество топлива сжигается и выделяет тепло, которое передается воде, находящейся в калориметре. Тепловая энергия, выделяющаяся при сгорании, измеряется как изменение температуры воды в калориметре. Путем расчета и сравнения значений можно определить удельную теплоту сгорания исследуемого вещества.
Для получения достоверных результатов при измерении удельной теплоты сгорания необходимо учитывать различные факторы, такие как потери тепла, изменение состояния окружающей среды и другие внешние воздействия. Поэтому проведение таких измерений требует тщательной калибровки и контроля параметров эксперимента.
| Компонент | Инструменты |
|---|---|
| Измерение количества топлива | Весы, контейнер |
| Измерение изменения температуры | Термометр |
| Измерение тепловой энергии | Калориметр |
После проведения измерений и вычисления удельной теплоты сгорания, полученные значения могут быть использованы для различных практических и научных целей, таких как расчет энергетической эффективности топлива или определение энергетической ценности продуктов сгорания.
Значение удельной теплоты сгорания для химических реакций
Удельная теплота сгорания - это количественная характеристика, которая определяет количество теплоты, выделяющейся или поглощаемой при полном сгорании вещества в определенных условиях. Значение удельной теплоты сгорания тесно связано с химическим составом вещества и позволяет оценить его энергетическую ценность.
Важно отметить, что значение удельной теплоты сгорания может различаться для разных веществ. Это связано с разными химическими связями в составе вещества и энергией, которая выделяется при их разрыве и образовании новых связей.
Удельная теплота сгорания выражается в джоулях на грамм или в килоджоулях на моль. Единица измерения килоджоуль на моль обычно используется для измерения удельной теплоты сгорания органических веществ.
Значение удельной теплоты сгорания является важным параметром при проведении реакций сгорания и позволяет оценить энергетическую эффективность химических процессов. Зная удельную теплоту сгорания веществ, можно рассчитать количество энергии, которое выделится или поглотится при реакции сгорания.
Как удельная теплота сгорания связана с энергией реакции
Связь удельной теплоты сгорания с энергией реакции объясняется законами сохранения энергии и термодинамики. При сгорании вещества происходит реакция окисления, в результате которой выделяется энергия. Энергия, выделяющаяся при сгорании, равна энергии реакции, так как энергия не может появиться из ниоткуда и не может исчезнуть без следа.
Для вычисления удельной теплоты сгорания часто используется тепловой эффект реакции, который определяется через энергию реакции. Тепловой эффект реакции является разностью между энергией реакционной системы до и после реакции.
Удельная теплота сгорания может быть рассчитана, зная количество выделяющейся энергии и массу сгоревшего вещества. Для этого используется формула:
| Удельная теплота сгорания (Q) | = | Тепловой эффект реакции (ΔH) | / | Масса вещества (m) |
|---|
Удельная теплота сгорания может быть положительной или отрицательной величиной в зависимости от характера реакции. Положительная удельная теплота сгорания свидетельствует о выделении энергии при сгорании вещества, а отрицательная удельная теплота сгорания указывает на поглощение энергии.
Расчет удельной теплоты сгорания на основе уравнения Вант-Гоффа

Для вычисления удельной теплоты сгорания можно использовать уравнение Вант-Гоффа. Это уравнение связывает удельную теплоту сгорания, молярные массы вещества и продуктов сгорания.
Уравнение Вант-Гоффа имеет следующий вид:
q = (ΔH / m) \times M
где q - удельная теплота сгорания, ΔH - изменение энтальпии реакции, m - молярная масса вещества и M - масса продуктов сгорания.
Для расчета удельной теплоты сгорания на основе уравнения Вант-Гоффа, необходимо знать значение изменения энтальпии реакции, молярную массу вещества и массу продуктов сгорания. Значение изменения энтальпии реакции можно получить из соответствующей химической реакции или использовать табличные значения. Молярную массу вещества можно найти в периодической системе элементов, а массу продуктов сгорания можно измерить экспериментально.
Пример расчета:
Пусть нам дан графит C (молярная масса 12,01 г/моль), и мы хотим вычислить его удельную теплоту сгорания. Из эксперимента известно, что при сгорании 1 графита образуется 393,5 кДж тепловой энергии. Подставив эти значения в уравнение Вант-Гоффа, получим:
q = (393,5 кДж / 1 моль) \times (12,01 г/моль)
Расчитав это выражение, мы получим значение удельной теплоты сгорания графита.
Таким образом, уравнение Вант-Гоффа позволяет нам вычислить удельную теплоту сгорания различных веществ. Эта физическая величина является важной при изучении химических реакций и может быть использована для определения энергетической ценности топлив и других веществ.
Методы определения удельной теплоты сгорания

Один из прямых методов – это измерение количества выделяемой теплоты при сгорании известной массы вещества в калориметре. Для этого вещество подвергают сгоранию в кислороде и измеряют изменение тепловой энергии, полученное благодаря выделению тепла.
Косвенные методы основаны на использовании закона Гесса и тепловых реакций. Один из этих методов – метод горения, при котором определяется изменение энергии при горении реагентов.
Другой косвенный метод – метод смешения, который заключается в измерении изменения тепловой энергии при смешении растворов и растворителей различных веществ.
Методы определения удельной теплоты сгорания являются важными инструментами в изучении энергетических свойств веществ и составляют основу для многих термохимических расчетов и применений в промышленности.