Химические реакции - это сложные процессы, которые происходят между молекулами веществ. Константа равновесия - это величина, которая описывает степень протекания химической реакции. Она показывает, насколько полное или неполное превращение реагентов в продукты. Однако, важно учитывать, что константа равновесия может зависеть от температуры, а это в свою очередь может существенно влиять на ход химической реакции.
Зависимость константы равновесия от температуры обусловлена термодинамическими законами. Вообще, закон Гиббса-Гельмгольца гласит, что степень превращения реагентов в продукты зависит от разницы энергий свободы между ними. Таким образом, при изменении температуры, изменяется энергия свободы и, следовательно, константа равновесия.
Интересно отметить, что зависимость константы равновесия от температуры может быть положительной или отрицательной. В случае положительной зависимости, увеличение температуры приведет к увеличению константы равновесия. Это означает, что химическая реакция будет протекать сильнее, а степень превращения реагентов в продукты будет выше. В случае отрицательной зависимости, увеличение температуры приведет к уменьшению константы равновесия. Это означает, что химическая реакция будет протекать слабее, а степень превращения реагентов в продукты будет ниже.
Знание зависимости константы равновесия от температуры играет важную роль в различных областях химии. Например, в промышленности это знание помогает оптимизировать процессы и повышать эффективность производства. Также, это знание широко применяется в фармацевтической индустрии при разработке лекарственных препаратов и в других сферах, где необходимо обеспечить управляемость химических реакций.
Влияние температуры на константу равновесия

Константа равновесия определяет соотношение между концентрациями реагирующих веществ в равновесной системе. Она выражается через отношение концентрации продуктов к концентрации реагентов и остается постоянной при постоянной температуре.
Однако при изменении температуры константа равновесия становится переменной и может существенно варьировать. В общем случае, при повышении температуры константа равновесия увеличивается, а при понижении температуры - уменьшается.
Изменение константы равновесия в зависимости от температуры объясняется сдвигом равновесия в направлении реакции с поглощением тепла или выделением тепла.
Если реакция сопровождается поглощением тепла, то повышение температуры приводит к увеличению константы равновесия, так как система стремится к снижению энергии и компенсации поглощенного тепла. В этом случае, повышение температуры способствует образованию большего количества продуктов реакции.
Если же реакция сопровождается выделением тепла, то повышение температуры приводит к уменьшению константы равновесия, так как система стремится к увеличению энергии и компенсации выделенного тепла. В этом случае, повышение температуры способствует образованию большего количества реагентов.
Изучение зависимости константы равновесия от температуры позволяет управлять химическими реакциями и оптимизировать условия их протекания. При проектировании каталитических процессов или разработке новых методов синтеза веществ, знание влияния температуры на константу равновесия помогает достичь нужной степени превращения реагентов или получить высокоочищенные продукты.
Зависимость константы равновесия от температуры
Когда температура в системе изменяется, скорости прямой и обратной реакций могут меняться по-разному. Если прямая реакция является экзотермической (выделяющей тепло), то увеличение температуры приведет к снижению скорости этой реакции. В то же время, если обратная реакция является эндотермической (поглощающей тепло), то увеличение температуры повысит скорость этой реакции.
Изменение скорости реакций влияет на константу равновесия. По принципу Ле Шателье, система стремится сместить равновесие в направлении, противоположном изменению условий. Если скорость прямой реакции увеличивается (продукты образуются быстрее), то чтобы сбалансировать это изменение, равновесие сместится в направлении обратной реакции. Таким образом, константа равновесия изменится.
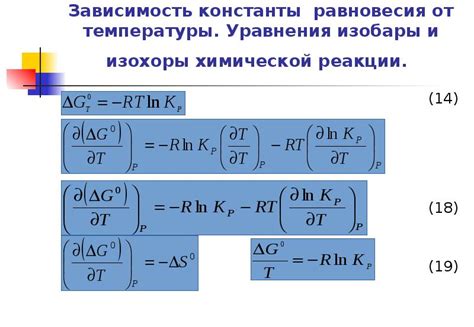
Зависимость константы равновесия от температуры может быть описана с помощью уравнения Вант-Гоффа:
ln K = -ΔH/RT + ΔS/R
где K - константа равновесия, ΔH - изменение энтальпии, ΔS - изменение энтропии, R - универсальная газовая постоянная, T - температура.
Это уравнение показывает, что константа равновесия зависит от энергетических изменений и изменений в хаосе системы. Поэтому изменение температуры может значительно влиять на значение константы равновесия и, соответственно, на положение равновесия в химической реакции.
Понимание зависимости константы равновесия от температуры является важным для контроля химических реакций и оптимизации процессов в промышленности. Изменение температуры может использоваться для изменения положения равновесия и увеличения выхода продуктов или реагентов в химической системе. Поэтому изучение этой зависимости является важной задачей в химии.
Значение зависимости для химических реакций

Константа равновесия обозначается как K и определяет отношение концентраций или давлений реагентов к концентрациям или давлениям продуктов в состоянии равновесия. Зависимость К от температуры может быть представлена уравнением Аррениуса:
K = A * e^(-∆H/RT)
Где A - коэффициент пропорциональности, ∆H - энтальпия реакции, R - универсальная газовая постоянная, T - температура в Кельвинах. Это уравнение показывает, что константа равновесия зависит от энергетических характеристик реакции и температуры.
Зависимость константы равновесия от температуры имеет двойственное значение для химических реакций. Во-первых, она позволяет предсказать направление реакции в зависимости от изменения температуры. Если значение K увеличивается с ростом температуры, то реакция считается термодинамически предпочтительной в прямом направлении. Если K уменьшается с ростом температуры, то реакция считается термодинамически предпочтительной в обратном направлении.
Таким образом, значимость зависимости константы равновесия от температуры в химических реакциях заключается в ее способности предсказывать направление и степень протекания реакции. Это позволяет исследователям и инженерам контролировать реакции, оптимизировать процессы и получать большее количество полезных продуктов.
Практическое применение различных температур

Практическое значение зависимости константы равновесия от температуры очевидно в различных областях химии и промышленности. Например, в производстве аммиака из водорода и азота при помощи габеровского процесса, оптимальная температура равна 450-500 градусов Цельсия и обеспечивает высокую конверсию сырья и выход аммиака. Поддержание заданной температуры является важным параметром для эффективной работы этого процесса.
Также, в синтезе алкилбензолов при помощи алкилирования толуола катализаторами на основе фосфовольфрамовой кислоты, оптимальная температура равновесия влияет на скорость реакции и селективность образования целевого продукта, что позволяет выбрать условия для максимального выхода продукта с желаемыми свойствами.
В металлургической промышленности также активно используется зависимость константы равновесия от температуры. Например, при производстве чугуна из железорудного оксида с углеродом, оптимальная температура позволяет достичь высокой конверсии реагентов и максимального выхода чугуна с желаемыми механическими и физическими свойствами.
Таким образом, знание влияния температуры на константу равновесия является важным для оптимизации химических реакций и процессов в различных отраслях промышленности. Определение и поддержание оптимальной температуры позволяет повысить эффективность производства и получение желаемых продуктов с требуемыми свойствами.