Коэффициенты - это числа, которые ставят перед формулами в химических уравнениях, чтобы соблюсти законы сохранения массы и заряда. Изучение коэффициентов в химии является важным и неотъемлемым этапом обучения в 8 классе. Знание правил и применение коэффициентов позволяют понять, как происходят различные химические реакции и как изменяются составы веществ.
Основное правило использования коэффициентов в химии - это соблюдение пропорций между количеством атомов различных элементов в реагентах и продуктах реакции. Коэффициенты указывают на соотношение между числом молекул или атомов веществ, участвующих в реакции. Они могут быть как целыми числами, так и дробными, но зачастую при записи уравнений используются только целочисленные коэффициенты.
Применение коэффициентов в химии позволяет выразить зависимость между массой или количеством вещества, участвующего в химической реакции. Они помогают определить, сколько вещества необходимо для проведения реакции или какие продукты образуются в результате. Коэффициенты также позволяют сбалансировать химическое уравнение, чтобы количество атомов каждого элемента в реагентах было равно количеству атомов в продуктах.
Основные коэффициенты в химии
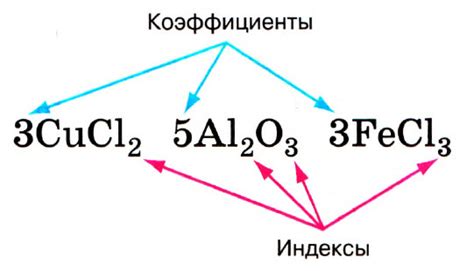
В химии существует несколько основных коэффициентов, которые играют важную роль при решении химических задач. Эти коэффициенты используются для обозначения количества вещества, степени окисления и балансировки химических уравнений.
Один из основных коэффициентов - это стехиометрический коэффициент. Он показывает, в каких пропорциях рассматриваемые вещества участвуют в реакции. Стехиометрический коэффициент позволяет установить соотношение между массой различных веществ в реакции.
Другим важным коэффициентом в химии является коэффициент окисления. Он указывает на изменение степени окисления атомов в химической реакции. Коэффициент окисления позволяет определить, происходит ли окисление или восстановление атома.
Особое внимание следует уделять балансировке химических уравнений. Балансировка химического уравнения - это процесс приведения количества атомов каждого элемента в реакции к равенству. Для этого используются коэффициенты, которые показывают, в каких пропорциях реагируют вещества.
Вместе эти коэффициенты помогают установить точное соотношение между веществами в реакции, определить изменение степени окисления атомов и балансировать химические уравнения. Знание основных коэффициентов в химии поможет лучше понять и решить различные задачи в этой науке.
Что такое коэффициенты

Коэффициенты позволяют определить соотношение между различными веществами, участвующими в химической реакции. Они указывают вес и количество вещества, которое нужно использовать или получить при реакции. Коэффициенты также позволяют прогнозировать результаты химических превращений и определять соотношение между продуктами и реагентами.
Когда уравнение химической реакции сбалансировано с помощью коэффициентов, количество атомов каждого элемента будет одинаково на обоих сторонах реакции. Это важно для понимания химических превращений и выполнения точных расчетов.
Без использования коэффициентов в химическом уравнении, оно будет недостаточно точным и не отразит реальное соотношение между реагентами и продуктами. Поэтому, ученики, изучающие химию, должны осознать важность правильного использования коэффициентов для балансировки уравнений и анализа химических реакций.
Правила использования коэффициентов
1. Коэффициенты используются для сбалансирования химических уравнений. Химическое уравнение должно отображать соотношение между реагентами и продуктами реакции. Вводя коэффициенты перед формулами веществ, мы обеспечиваем равенство числа атомов каждого элемента в реагентах и продуктах.
2. Коэффициенты должны быть наименьшими возможными целыми числами. Коэффициент перед каждой формулой вещества устанавливается таким образом, чтобы число атомов каждого элемента в реагентах и продуктах было одинаковым. Поэтому коэффициенты пытаются сделать наименьшими возможными, чтобы соотношение элементов оставалось правильным.
3. Коэффициенты нужно применять к каждому атому вещества в уравнении. Коэффициент перед формулой вещества умножается на каждый атом этого вещества в уравнении. Например, если перед формулой H2O стоит коэффициент 2, то это означает, что в уравнении присутствуют 2 атома водорода и 1 атом кислорода.
4. Коэффициенты должны быть простыми и их можно сокращать. При сбалансированном уравнении, коэффициенты перед формулами веществ не должны иметь общих множителей. Если в уравнении после сокращения коэффициенты остаются нецелыми, то они могут быть умножены на общий множитель, чтобы сделать их целыми.
5. Коэффициент 1 можен опускаться. Если перед формулой вещества стоит одинаковое количество атомов в реагентах и продуктах, то коэффициент 1 может быть опущен. Например, если уравнение имеет вид 2H2 + O2 → 2H2O, то можно записать как H2 + O2 → 2H2O, опустив коэффициент перед водой.
Применение коэффициентов позволяет сбалансировать химические реакции и точно определить соотношение между реагентами и продуктами. Правильное использование коэффициентов является важной составляющей химических расчетов и анализа реакций.
Применение коэффициентов в химических реакциях

Коэффициенты в химических реакциях играют важную роль и позволяют соблюдать закон сохранения массы. Уравнение химической реакции показывает, какие вещества реагируют и какие вещества образуются в результате реакции.
Коэффициенты перед формулами веществ указывают на количество молекул или атомов, участвующих в реакции. Они помогают соблюсти закон сохранения массы, по которому сумма масс реагентов должна равняться сумме масс продуктов.
При решении химических задач важно правильно подобрать коэффициенты, чтобы сохранить баланс между атомами веществ. Например, если в уравнении реакции есть 2 атома кислорода на одну молекулу глюкозы, то для получения сбалансированного уравнения нужно добавить коэффициент 6 перед формулой глюкозы, чтобы суммарно получить 12 атомов кислорода на обеих сторонах реакции.
Использование коэффициентов также позволяет определить соотношение масс веществ, участвующих в реакции. По коэффициентам можно вычислить количество реагентов и продуктов на основе заданных масс или объемов веществ. Это важно при проведении химических расчетов и определении эффективности реакции.
Итак, коэффициенты в химических реакциях являются неотъемлемой частью уравнений и позволяют соблюдать баланс и закон сохранения массы. Они также участвуют в расчетах и определении количества реагентов и продуктов. Правильное применение коэффициентов позволяет достичь точности и надежности результатов химических исследований и процессов.
Особенности применения коэффициентов в химии 8 класса

Одним из основных правил применения коэффициентов в химии является его балансировка. Балансировка уравнений химических реакций позволяет соблюсти закон сохранения массы, то есть количество атомов каждого элемента должно быть одинаковым на обеих сторонах уравнения. Для балансировки нужно изменять коэффициенты перед формулами веществ, чтобы соблюсти это правило.
Коэффициенты также используются для определения количества веществ, участвующих в реакции. По коэффициентам можно вычислить, сколько молей или граммов вещества участвует в реакции, а также сколько молей или граммов продуктов образуется. Это позволяет проводить расчеты и определять количественные характеристики реакции.
Правильное применение коэффициентов также помогает понять принципы химических реакций и механизмы, с помощью которых происходит превращение веществ. Они позволяют установить соотношения между различными веществами и объяснить, почему определенный продукт образуется в результате реакции.
Важно запомнить, что коэффициенты в химии 8 класса имеют определенную значимость и не могут быть произвольно выбраны. Они должны соответствовать балансировке уравнения и показывать реальные соотношения между веществами в реакции.
Таким образом, понимание и правильное применение коэффициентов в химии 8 класса являются важной особенностью изучения этой науки. Они помогают установить соотношения между веществами, проводить расчеты и объяснять механизмы реакций.
Как определить значения коэффициентов
Для определения значений коэффициентов следует руководствоваться несколькими правилами:
1. Запись уравнения.
Вначале необходимо записать уравнение для реакции, указав все исходные вещества и полученные продукты. Здесь важно правильно указать формулы веществ и их стехиометрические коэффициенты (порядок и количество атомов каждого элемента в формуле).
2. Балансировка уравнения.
Далее следует балансировка уравнения путем добавления коэффициентов перед формулами веществ. Балансировка выполняется так, чтобы количество атомов каждого элемента было одинаковым на обеих сторонах уравнения.
3. Использование пропорций.
После балансировки можно использовать пропорции для определения значений неизвестных коэффициентов. Например, если в уравнении имеется один неизвестный коэффициент, то можно использовать соотношение между известным коэффициентом и количеством атомов элемента или соединения.
Правильное определение значений коэффициентов позволяет установить соотношения между веществами в химической реакции и провести необходимые расчеты, связанные с количеством веществ, массой и объемом.
Результаты применения коэффициентов в химии 8 класса

Коэффициенты в химии 8 класса играют важную роль в балансировке химических уравнений. Их правильное применение позволяет достичь точного соотношения между реагентами и продуктами химической реакции. Результаты применения коэффициентов могут быть представлены в виде таблицы.
| Реагенты | Продукты |
|---|---|
| Вещество A: 2A | 2B + C |
| Вещество D: 3D | 3E + F |
| Вещество G: 4G | 4H + I |
Из таблицы видно, что применение коэффициентов позволяет получить правильное соотношение между реагентами и продуктами. Например, если в химической реакции участвует 2 молекулы вещества A и 4 молекулы вещества G, то после реакции будет образовано соответственно 4 молекулы вещества B и 8 молекул вещества H.
Коэффициенты также позволяют соблюдать закон сохранения массы при химических реакциях. Если количество атомов в реагентах не равно количеству атомов в продуктах, то реакция будет несбалансированной и не может протекать. Благодаря использованию коэффициентов возможно соблюдение баланса между реагентами и продуктами, а следовательно, и успешное осуществление химической реакции.
Таким образом, правильное применение коэффициентов в химии 8 класса позволяет достичь корректной и сбалансированной записи химических уравнений, а также соблюдение законов сохранения массы. Они являются важным инструментом в изучении и понимании химических реакций.