Количество избыточных электронов в химической формуле - это число электронов, которые не участвуют в образовании химических связей в молекуле. Избыточные электроны могут быть связаны с атомом или находиться в свободном состоянии. Такие электроны вносят вклад в свойства и поведение соединения, и поэтому их количество является важной характеристикой.
Определение и расчет количества избыточных электронов в формуле молекулы можно провести с помощью правила октета. По этому правилу, атомы стремятся образовать октет электронов во внешнем энергетическом уровне, заполняя все свои энергетические оболочки так, чтобы их конфигурация напоминала стабильную конфигурацию инертных газов. Избыточные электроны распределяются таким образом, чтобы молекула приобрела наиболее энергетически выгодную конфигурацию.
Для расчета количества избыточных электронов в формуле молекулы нужно вычислить число электронов, принадлежащих атомам в молекуле, и вычесть из него число электронов, необходимых для создания связей между атомами в молекуле. Также стоит отметить, что избыточные электроны могут играть важную роль в процессах реакций и обладать различными химическими свойствами, влияя на реакционную способность молекулы.
Что такое избыточные электроны?

Образование избыточных электронов может происходить в результате различных процессов, таких как химические реакции или взаимодействие с внешними источниками электронов, например, электрической разрядкой. Когда атом или молекула получает дополнительные электроны, они могут находиться на внешних энергетических оболочках и образовывать избыточный отрицательный заряд.
Избыток электронов может вызывать различные электрические и химические реакции, такие как образование анионов или участие в каталитических процессах. Он также может привести к изменению свойств атома или молекулы, включая его реакционную способность и стабильность.
Важно отметить, что избыточные электроны не являются стандартным состоянием для большинства атомов и молекул, поскольку они стремятся к нейтральному состоянию, где число электронов равно числу протонов.
Как определить количество избыточных электронов в формуле?

Количество избыточных электронов в формуле химического соединения определяется на основе сравнения общего числа электронов в атомах и общего числа электронов в соединении.
Для начала необходимо выяснить, сколько электронов принадлежит каждому атому, которые участвуют в соединении. В этом можно помочь электронной конфигурации атомов, которая показывает количество электронов каждого уровня и подуровня энергии.
Затем следует определить общее количество электронов, принадлежащих атомам в формуле соединения. Это может быть сделано путем сложения электронных конфигураций всех атомов и учета зарядов ионов, если они присутствуют в соединении.
После этого необходимо узнать, сколько электронов реально присутствует в соединении. Обычно это равно числу внешних электронов в атомах, но могут быть случаи, когда электроны переносятся между атомами или образуются новые связи.
И наконец, для определения количество избыточных электронов необходимо вычесть количество реально присутствующих электронов из общего количества электронов, принадлежащих атомам в формуле соединения.
Например, если общее количество электронов в формуле соединения равно 10, а количество реально присутствующих электронов равно 8, то количество избыточных электронов равно 2.
Каким образом производится расчет избыточных электронов?

Для любого атома в химическом соединении можно вычислить формальный заряд с использованием следующей формулы:
Формальный заряд = количество валентных электронов - количество несвязанных электронов - количество связанных электронов/2После рассчета формального заряда для каждого атома в молекуле можно определить количество избыточных электронов. Избыточные электроны обычно обозначаются со знаком "-". Если формальный заряд положителен, это означает, что электроны перераспределены в сторону другого атома и этот атом имеет недостаток электронов.
Расчет избыточных электронов позволяет более точно оценить химическую активность и реакционную способность соединений. Он является важной составляющей химической теории и позволяет предсказать поведение молекул в различных условиях.
Практическое значение избыточных электронов в формуле

Избыточные электроны в химической формуле имеют важное практическое значение и находят свое применение в различных областях науки и технологии.
В биохимии, избыточные электроны используются для описания влияния различных функциональных групп в молекулах белков, нуклеиновых кислот и других органических соединений. Избыточные электроны помогают определить электронные плотности и связи в молекуле, что позволяет лучше понять ее структуру и функцию.
В электрохимии, избыточные электроны используются для описания электрохимических реакций и процессов. Например, избыточные электроны помогают определить электродный потенциал и проводимость раствора, что является важной информацией при разработке новых электрохимических устройств и батарей.
Избыточные электроны также имеют значение в катализе. Понимание электронных свойств каталитической поверхности позволяет оптимизировать процессы катализа и повысить эффективность химических реакций.
Кроме того, избыточные электроны играют важную роль в полупроводниковой технологии. Они используются для создания электронных компонентов, таких как транзисторы и диоды, которые являются основой современной электроники.
Примеры расчета количества избыточных электронов
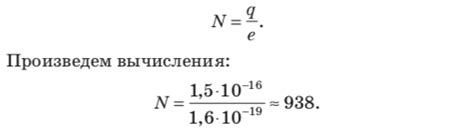
Расчет количества избыточных электронов в формуле химического соединения подразумевает определение количества электронов, присутствующих внутри формулы, и сравнение этого числа с электронной окраской стандартного состояния элементов. Рассмотрим несколько примеров расчета количества избыточных электронов:
- Пример 1: Кислород воды (H2O)
- Пример 2: Аммиак (NH3)
- Пример 3: Озон (O3)
В молекуле воды содержится 2 атома водорода и 1 атом кислорода. В стандартном состоянии кислород имеет 6 электронов, а водород - 1 электрон. Суммируя электроны в молекуле воды, получим:
2 * 1 + 1 * 6 = 8
Таким образом, в молекуле воды содержится 8 электронов. Это количество превышает электронную окраску стандартного состояния кислорода и водорода. Разность между фактическим количеством электронов и электронной окраской называется избыточным количеством электронов. В случае молекулы воды:
8 - (2 * 2 + 1 * 6) = 8 - 10 = -2
Таким образом, в данном случае количество избыточных электронов равно -2.
В молекуле аммиака содержится 1 атом азота и 3 атома водорода. В стандартном состоянии азот имеет 5 электронов, а водород - 1 электрон. Суммируя электроны в молекуле аммиака, получим:
1 * 5 + 3 * 1 = 5 + 3 = 8
Таким образом, в молекуле аммиака содержится 8 электронов. Это количество соответствует электронной окраске стандартного состояния азота и водорода. Разность между фактическим количеством электронов и электронной окраской равна нулю, то есть в данном случае избыточные электроны отсутствуют.
В молекуле озона содержится 3 атома кислорода. В стандартном состоянии кислород имеет 6 электронов. Суммируя электроны в молекуле озона, получим:
3 * 6 = 18
Таким образом, в молекуле озона содержится 18 электронов. Это количество превышает электронную окраску стандартного состояния кислорода. Разность между фактическим количеством электронов и электронной окраской называется избыточным количеством электронов. В данном случае:
18 - 3 * 6 = 18 - 18 = 0
Таким образом, в данном случае количество избыточных электронов равно 0.