Изотопы – это разновидности атомов, имеющие одинаковое количество протонов в ядре, но различающиеся количеством нейтронов. Количество нуклонов, т.е. протонов и нейтронов, является важным параметром в химии и физике. Оно определяет химические свойства атома, его стабильность и радиоактивность.
Таблица изотопов позволяет визуализировать количество нуклонов для каждого изотопа. В таблице перечислены элементы, их атомные номера (количество протонов), а также массовые числа, которые отражают общее количество нуклонов в ядре. Например, у изотопа урана, обозначенного как ^235U (где 235 – это массовое число), 92 протона и 143 нейтрона.
Для удобства поиска доступных изотопов можно использовать специальные базы данных. В них можно найти информацию о количестве нуклонов и других свойствах изотопов различных элементов. Такие базы данных полезны в научных исследованиях, химической и физической промышленности, а также в ядерной физике. Они помогают устанавливать связь между структурой атома и его свойствами.
Что такое нуклон и изотоп
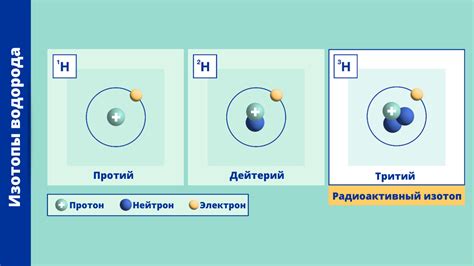
Изотопы - это атомы одного и того же элемента, но с различным количеством нуклонов в их ядре. Такие атомы имеют одинаковое количество протонов и разное количество нейтронов. Изотопы могут быть стабильными или нестабильными (радиоактивными).
Классификация изотопов осуществляется на основе количества нейтронов, а протоны во всех изотопах одного элемента остаются неизменными. Изотопы обозначаются специальными обозначениями, включающими символы элемента и общее количество нуклонов в ядре.
Один из способов представления информации об изотопах - использование таблицы, в которой указывается количество протонов, нейтронов и общее количество нуклонов в ядре для различных изотопов одного элемента. Такие таблицы помогают визуализировать различия и зависимости между изотопами.
| Протоны | Нейтроны | Нуклоны | Обозначение |
|---|---|---|---|
| 6 | 6 | 12 | C-12 |
| 6 | 7 | 13 | C-13 |
| 6 | 8 | 14 | C-14 |
В приведенной таблице показаны изотопы углерода. Углерод имеет 6 протонов в ядре, а количество нейтронов различается для каждого изотопа. Примеры изотопов углерода: C-12, C-13, C-14.
Составление таблицы изотопов

Таблица изотопов представляет собой справочник, содержащий информацию о количестве нуклонов в изотопе. Каждая запись в таблице представлена в виде строки, в которой указаны символ химического элемента, атомный номер, массовое число и полураспад.
Составление таблицы изотопов является важной задачей в ядерной физике и химии. Для этого требуется собрать данные обо всех известных изотопах и организовать их в удобном формате.
Для составления таблицы изотопов можно использовать различные источники данных, такие как специализированные справочники по ядерной физике и химии, а также базы данных. В таблице указывается символ элемента, атомный номер, массовое число и полураспад, который позволяет оценить стабильность изотопа.
Однако следует отметить, что таблица изотопов является динамическим объектом, поскольку новые изотопы могут быть обнаружены или их свойства могут быть дополнены в связи с проведением новых исследований. Поэтому регулярное обновление данных в таблице изотопов является важной задачей для поддержания актуальности информации.
Таким образом, составление и обновление таблицы изотопов являются важной работой в научном сообществе и способствуют углублению знаний о структуре и свойствах атомных ядер.
Нахождение количества нуклонов в изотопе

Атомный номер элемента указывает на количество протонов в ядре. Массовое число же равно сумме протонов и нейтронов в ядре. Чтобы найти количество нуклонов, нужно сложить количество протонов и нейтронов.
Количество нейтронов можно найти, вычтя из массового числа атомный номер. Зная количество нуклонов в изотопе, можно провести дальнейшие расчёты и выяснить его свойства и структуру.
Поиск доступных изотопов

В таблице изотопов можно быстро найти конкретный элемент и всю информацию о его изотопах. Например, если вы хотите найти количество нуклонов в изотопе урана, вы можете просмотреть строку с символом "U" и найти нужную информацию.
Таблица изотопов также может быть использована для сравнения разных элементов и их изотопов. Вы можете найти элементы с наибольшим и наименьшим количеством нуклонов, а также изотопы с самым длинным и самым коротким периодом полураспада.
Если таблица изотопов не доступна, вы можете воспользоваться интернет-ресурсами или специализированными программами для поиска изотопов. Некоторые из них предоставляют расширенные возможности по поиску и сортировке изотопов по различным параметрам, таким как масса и период полураспада.
| Элемент | Количество нуклонов | Масса | Период полураспада |
|---|---|---|---|
| Уран (U) | 92 | 238.02891 | 4.468 млрд лет |
| Уран (U) | 92 | 235.04393 | 703,800 лет |
| Уран (U) | 92 | 234.04095 | 245,500 год |
| Уран (U) | 92 | 233.03963 | 159,200 год |
Таблица изотопов предоставляет полезную информацию о доступных изотопах элементов. Она является основой для изучения свойств и использования изотопов в различных областях науки и техники.
Практическое применение информации о количестве нуклонов в изотопах

Информация о количестве нуклонов в изотопах имеет широкое практическое применение в различных областях науки и техники. Ниже приведены некоторые примеры использования этой информации:
1. Ядерная энергетика: Зная количество нуклонов в изотопе, можно определить его ядерные свойства, такие как массовое число и энергию связи ядра. Это помогает в проектировании и контроле ядерных реакторов и ядерных бомб.
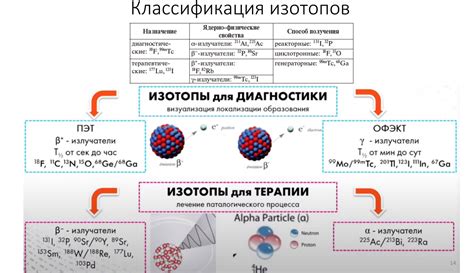
2. Медицина: Изотопы с различными количествами нуклонов используются в ядерной медицине для диагностики и лечения различных заболеваний. Например, изотопы радиоактивного йода используются для лечения рака щитовидной железы, а изотоп технеция-99m используется для образования изображений в рамках визуализации определенных органов и тканей.
3. Археология и геология: Изотопы с различным количеством нуклонов используются для определения возраста древних материалов, таких как окаменелости и археологические находки. Метод радиоуглеродного датирования основан на распаде радиоактивного изотопа углерода-14.
4. Космология: Известное количество нуклонов в изотопах позволяет исследовать процессы, происходящие во Вселенной. Например, изотопы водорода и гелия играют важную роль в моделях Большого Взрыва и в детектировании космического излучения.
5. Промышленность: Изотопы с различными количествами нуклонов используются в промышленности для рентгеновского контроля, исследования материалов методом позитронной эмиссионной томографии (ПЭТ-сканеры) и других приложений, связанных с элементарными частицами.
Таким образом, информация о количестве нуклонов в изотопах является важным фундаментальным знанием для множества научных и технических областей и оказывает значительное влияние на развитие и прогресс человечества.
Ключевые факты о нуклонах и изотопах
Изотопы - это атомы одного и того же элемента, у которых число нуклонов в ядре различно. Изотопы химический элемент обладают одним и тем же атомным номером (число протонов), но различным атомным массовым числом (число протонов и нейтронов в ядре). Поэтому, изотопы одного и того же элемента имеют различные физические и химические свойства.
Интересно, что некоторые изотопы являются радиоактивными, то есть они подвержены распаду с течением времени. Это связано с нестабильностью их ядер. Распад идет в результате выброса частиц и/или излучения из ядра. Радиоактивные изотопы используются в медицине, научных исследованиях и в различных промышленных процессах.
Важно отметить, что изотопы могут быть полезными в различных областях науки и технологии. Например, стабильные изотопы используются в радиоуглеродном методе определения возраста материалов, а радиоактивные изотопы применяются в радионуклидной терапии и радиоизотопных исследованиях. Кроме того, изотопы играют важную роль в ядерной энергетике и ядерном оружии.