В химии эквивалент - это величина, которая определяет отношение между массой и количеством вещества в реакции. Важно понимать, как определить эквивалент вещества, чтобы правильно проводить химические расчеты и анализы.
Одним из основных методов определения эквивалента является использование стехиометрической формулы. С помощью этой формулы можно установить соотношение между веществами, приняв одно вещество в роли стандартного эквивалента. Для того чтобы определить эквивалент, необходимо установить мольную массу стандартного вещества и количество вещества в данной массе.
Важно также учитывать, что эквивалентные массы двух веществ должны быть одинаковыми, если они участвуют в той же реакции. Если вещества участвуют в разных реакциях, то их эквивалентные массы могут быть разными. Для определения эквивалента используют формулу: эквивалент = масса вещества / эквивалентная масса.
Необходимо помнить, что в зависимости от типа реакции и элемента, эквивалент может выражаться разными единицами измерения. Например, в некоторых случаях эквивалент может быть выражен в молях, а в других - в граммах. При проведении химических расчетов и анализов следует учитывать данные единицы измерения и правильно их применять.
Зачем нужно определение эквивалента вещества

Знание эквивалента вещества позволяет химикам рассчитать не только количество реагента, необходимого для проведения реакции, но и количество продукта, образующегося в результате реакции. Для этого используется простая формула:
Масса вещества = эквивалентная масса * количество эквивалентов
Определение эквивалента вещества также играет важную роль при проведении титрования, методе количественного анализа, который основан на точном определении количества вещества в растворе путем измерения объема раствора стандартного реактива, который точно известен по своей концентрации.
Зачастую, вещества вступают в реакцию в разных пропорциях, поэтому знание эквивалента вещества позволяет сравнивать и стандартизировать реакция на основе их стехиометрических соотношений. Это особенно важно в химическом анализе и производстве, где точность и надежность реакций являются основными требованиями.
Основные методы определения эквивалента вещества

Определение эквивалента вещества является важным понятием в химии и используется в различных химических расчетах. Существует несколько методов определения эквивалента вещества, которые основываются на различных принципах и идеях.
- Метод оксисоединений. Этот метод основан на определении эквивалента вещества на основе количества кислорода, которое оно содержит. Например, эквивалент кислорода равен 16 г/моль, поэтому для определения эквивалента хлора можно использовать уравнение: Cl2 + 2e- → 2Cl-. Эквивалент хлора будет равен половине молярной массы Cl2.
- Метод тритейскальциирования. В этом методе эквивалент вещества определяется по количеству тройных связей, которые оно содержит. Например, эквивалент этилена будет равен половине молярной массы этана, так как он содержит одну тройную связь.
- Метод нейтрализационной реакции. Этот метод основан на определении эквивалента вещества по количеству кислоты или щелочи, необходимых для полной нейтрализации. Например, эквивалент кислоты будет равен массе кислоты, необходимой для нейтрализации 1 эквивалента щелочи, а эквивалент щелочи будет равен массе щелочи, необходимой для нейтрализации 1 эквивалента кислоты.
Каждый из методов имеет свои преимущества и недостатки, и выбор метода зависит от конкретного случая и типа вещества, которое необходимо определить. Химики используют эти методы для проведения различных химических расчетов и анализа веществ.
Метод процентного содержания

Для определения процентного содержания элемента в веществе, необходимо знать массу этого элемента и общую массу вещества. Формула для расчета процентного содержания выглядит следующим образом:
Процентное содержание элемента = (масса элемента / общая масса вещества) * 100%
Процентное содержание элемента может быть определено для различных типов веществ, таких как соединения и растворы. Для соединений, таких как соли или оксиды, масса элемента определяется путем взвешивания образца вещества, а общая масса вещества - путем сложения масс всех элементов, образующих вещество.
Для растворов, процентное содержание элемента можно определить путем измерения массы элемента или его соединения перед и после выпаривания раствора. Разность масс дает массу элемента, а общую массу вещества можно найти как сумму масс растворителя и растворенного вещества.
Метод процентного содержания является важным в химическом анализе, так как он позволяет определить количество и состав элементов в различных веществах. Этот метод широко используется в химической промышленности, научных исследованиях и образовательных целях.
Метод эквивалентных перекисей
В ходе реакции перекись подвергается окислению, при этом изменяется ее окислительная способность. Определение эквивалента вещества происходит путем определения количества эквивалента окислителя, которое реагирует с данной перекисью.
Метод эквивалентных перекисей широко применяется при определении эквивалента различных веществ. Он позволяет точно определить количество эквивалента вещества, а также исследовать его окислительную способность.
Этот метод особенно полезен при определении эквивалента веществ, у которых сложно определить точную массу или объем. Применение метода эквивалентных перекисей позволяет достичь высокой точности и надежности результатов определения эквивалента вещества.
Метод титрования

Основным принципом метода титрования является использование титровочного раствора, содержащего известное количество одного вещества, для реагирования с неизвестным количеством другого вещества. При добавлении титровочного раствора к анализируемому раствору происходит химическая реакция, которая позволяет определить эквивалентное количество вещества.
Одним из самых распространенных примеров титрования является кислотно-щелочная титровка, при которой измеряется точное количество раствора кислоты или щелочи, необходимое для достижения нейтрального pH. При этом используется индикатор, который меняет цвет в зависимости от pH раствора и позволяет точно определить момент окончания реакции.
Метод титрования широко применяется в аналитической химии для определения концентрации различных веществ, таких как кислоты, основания, оксиданты и т. д. Он позволяет получить точные результаты, при условии правильной подготовки растворов и использования точного объемного измерения.
Как определить эквивалент вещества: основные формулы
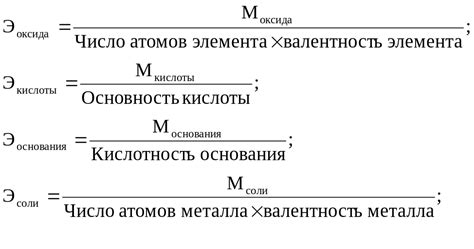
Существует несколько основных формул для определения эквивалента вещества:
Формула эквивалентной массы:
Эквивалентная масса вычисляется по формуле:
E = m/n
где E - эквивалентная масса, m - масса вещества в граммах, n - количество вещества в молях. Это формула позволяет определить количество граммов вещества, соответствующего одному эквиваленту.
Формула эквивалентного объема газа:
Для газов можно использовать формулу эквивалентного объема:
V = Vm / n
где V - эквивалентный объем, Vm - молярный объем газа в литрах, n - количество вещества в молях. Эта формула позволяет определить объем газа, соответствующий одному эквиваленту.
Формула стехиометрического коэффициента:
Для реакций, которые не происходят в растворе или с участием газов, можно использовать формулу стехиометрического коэффициента:
aA + bB → cC + dD
где a, b, c, d - стехиометрические коэффициенты, соответствующие количеству молекул каждого вещества в уравнении реакции. Эта формула позволяет определить соотношение между количеством вещества, вступающего в реакцию.
Использование этих формул поможет вам определить эквивалент вещества в различных химических реакциях и провести расчеты с учетом его значения.