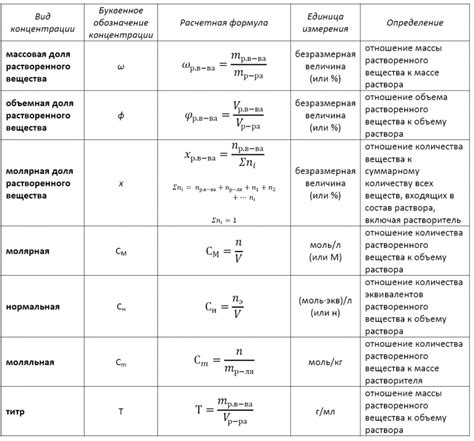
Анализ растворов является важной задачей в химической и аналитической химии. Одним из ключевых параметров при анализе является масса растворенного вещества. Определение массы вещества в растворе может производиться различными методами, в зависимости от исследуемого вещества и целей исследования.
Один из основных методов - гравиметрический, основанный на определении массы вещества путем его отделения от раствора. Для этого используются различные физико-химические процессы, такие как осаждение, выпаривание или экстракция. Гравиметрический метод является точным и надежным, однако требует длительного времени и сложной подготовки образца.
Другим распространенным методом является волнометрия, основанная на измерении объема или концентрации раствора. При этом используются устройства, такие как весы, бюретки или спектрофотометры. Волнометрия позволяет получить быстрые и точные результаты, особенно при измерении концентрации раствора.
Методы определения массы вещества в растворе: обзор и сравнение
- Взвешивание: один из наиболее точных и надежных методов определения массы вещества в растворе. Он основан на измерении массы с помощью весов. При этом необходимо знать массу чистого растворителя и после растворения в нем вещества, определить изменение массы.
- Флотация: метод, основанный на разделении раствора на две фазы - твердую и жидкую. Этот метод хорошо подходит для определения массы легкосмешиваемых веществ, которые могут всплывать на поверхность. Определение массы вещества производится путем измерения массы флотационного концентрата.
- Экстракция: метод, основанный на разделении раствора на две фазы - органическую и водную. Этот метод используется для определения массы вещества, которые легко растворяются в органических растворителях. Масса вещества определяется путем измерения массы органической фазы после экстракции.
- Метод капельной чувствительности: метод, основанный на измерении массы капель и вычислении концентрации вещества в растворе. В этом методе используется специальное устройство, которое позволяет точно измерить массу капель и определить массу вещества.
Каждый из перечисленных методов имеет свои преимущества и ограничения. При выборе метода необходимо учитывать его точность, простоту использования, время выполнения, стоимость и возможность автоматизации. В зависимости от поставленной задачи и требований можно выбрать наиболее подходящий метод определения массы вещества в растворе.
Гравиметрический метод и его особенности

Основным принципом гравиметрического метода является анализ осадка, образующегося после реакции между исследуемым веществом и реагентом. После получения осадка, он обычно фильтруется, высушивается и взвешивается. Разница массы до и после реакции позволяет определить массу исследуемого вещества в растворе.
Особенностью гравиметрического метода является его высокая точность. Точность измерения массы образца может быть достигнута благодаря использованию точных весов и соблюдению определенных технических требований при проведении анализа.
Гравиметрический метод широко используется в аналитической химии для определения содержания определенных компонентов в растворе. Он может быть применен для определения содержания солей, металлов, органических веществ и других компонентов.
Одним из примеров применения гравиметрического метода является определение содержания серебра в растворе. Для этого используется реактив, который образует с серебром нерастворимые осадки. Полученный осадок подвергается фильтрованию, высушиванию и взвешиванию для определения его массы. Затем, с помощью простых расчетов, можно определить содержание серебра в исследуемом растворе.
Титриметрический метод и его применение

Принцип титриметрического метода заключается в добавлении титранта - реактивного раствора с известной концентрацией - к раствору анализируемого вещества с неизвестной концентрацией. Реакция между титрантом и анализируемым веществом происходит до достижения эквивалентной точки, что позволяет определить концентрацию анализируемого вещества путем измерения объема раствора с добавленным титрантом.
Титриметрия широко применяется в различных областях, включая фармацевтическую, пищевую, аналитическую и окружающую среду. Например, для определения концентрации кислоты в растворе может применяться нейтрализационная титриметрия. В таком случае, щелочь используется в качестве титранта для реакции с кислотой.
Еще одним примером является окислительная титриметрия, которая используется для определения содержания органических соединений. В данном случае, окислитель используется в качестве титранта для реакции с анализируемыми соединениями.
Титриметрический метод позволяет получить точные результаты путем проведения нескольких измерений и усреднения полученных значений. Однако, для успешного применения титриметрии, необходимо учесть ряд факторов, таких как правильный выбор титранта и индикатора, а также обеспечение правильных условий проведения титрования.
В итоге, титриметрия является незаменимым методом в аналитической химии, который позволяет определить концентрацию вещества с высокой точностью и применить его в различных областях науки и промышленности.
Спектрофотометрический метод и его достоинства

Высокая точность измерений. Спектрофотометрический метод позволяет получить точные значения поглощения света веществом. Это достигается благодаря использованию калибровочных стандартов и калибровочных кривых, а также за счет отсутствия механических воздействий на раствор и простоты устройства прибора.
Широкий динамический диапазон. Спектрофотометрический метод позволяет измерять поглощение света веществом в широком диапазоне концентраций. Это позволяет использовать данный метод как для анализа растворов с высокой концентрацией вещества, так и с низкой концентрацией.
Возможность определения специфических веществ. Спектрофотометрический метод позволяет определить специфические вещества с помощью анализа их спектральных характеристик. Это особенно полезно при изучении сложных смесей или при поиске определенного вещества в растворе.
Быстрота измерений. Спектрофотометрический метод позволяет проводить измерения в реальном времени. Это обеспечивает быстрое получение результатов и позволяет контролировать процесс изменения концентрации вещества в растворе.
Необходимость небольшого количества образца. Для проведения спектрофотометрического анализа требуется всего небольшое количество образца. Это позволяет экономить время и ресурсы при проведении экспериментов.
Возможность автоматизации. Спектрофотометрические приборы могут быть автоматизированы, что позволяет снизить влияние человеческого фактора на результаты измерений и увеличить точность анализа.
Использование спектрофотометрического метода для определения массы вещества в растворе имеет ряд значительных достоинств, делающих его предпочтительным при выборе метода анализа. Комбинация точности, широкого динамического диапазона, возможности определения специфических веществ, быстроты измерений, необходимости небольшого количества образца и возможности автоматизации делает спектрофотометрический метод незаменимым инструментом в научных исследованиях и производстве.
Электрохимический метод и его ограничения

Этот метод широко используется в аналитической химии для определения концентрации вещества в растворе. Для этого применяют электрохимические методы, такие как амперометрия, потенциометрия, вольтамперометрия.
Однако электрохимический метод имеет некоторые ограничения:
- Он требует специализированного оборудования и электродов.
- Получение точных результатов требует опыта и навыков испытателя.
- Некоторые реакции могут быть сложными или медленными, что может затруднять использование электрохимического метода.
- Некоторые реакции могут быть чувствительными к присутствию других веществ в растворе, что может влиять на полученные результаты.
- Электрохимический метод может быть не применим, если вещество имеет низкую электрическую проводимость или не может быть окислено или восстановлено электродами.
Несмотря на эти ограничения, электрохимический метод является важным инструментом в аналитической химии и широко применяется в лабораториях для определения массы вещества в растворе.
Примеры применения методов при определении массы вещества в растворе
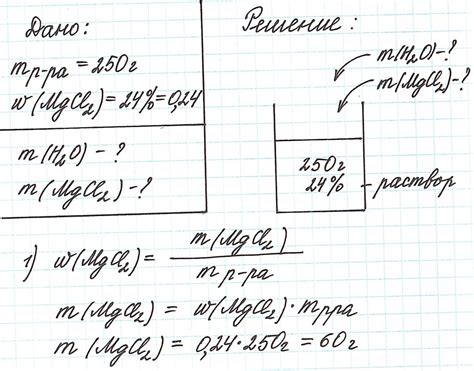
Один из примеров применения методов – гравиметрический метод. При выполнении такого метода, масса вещества определяется на основе измерения массы образовавшегося осадка. Например, для определения массы хлорида серебра в растворе, можно добавить известное избыток хлорида на раствор серебра, а затем определить массу полученного осадка серебра хлорида.
Еще одним методом является титриметрия, который основан на измерении объема раствора-титрента, необходимого для полного реагирования с веществом в растворе. Например, при определении массы цинка в растворе, можно использовать раствор серной кислоты в качестве титрента. Объем раствора-титрента, необходимого для нейтрализации, будет пропорционален массе цинка в растворе.
Еще одним примером является спектрофотометрия. Этот метод позволяет определить концентрацию вещества в растворе на основе измерения поглощения света. Например, при определении массы железа в растворе, можно использовать железо в форме ионов железа (Fe3+). Поглощение света данными ионами будет пропорционально их концентрации в растворе и, соответственно, массе железа.
| Метод | Пример вещества в растворе |
|---|---|
| Гравиметрия | Масса хлорида серебра |
| Титриметрия | Масса цинка |
| Спектрофотометрия | Масса железа |
Все эти методы позволяют определить массу вещества в растворе с высокой точностью и надежностью. Выбор метода зависит от химических свойств вещества, требуемой точности и доступности необходимых инструментов и реагентов.