Металлическая связь - это особый тип химической связи, который формируется между атомами металла. Одной из особенностей металлической связи является то, что она ненаправленная и ненасыщенная. Это означает, что каждый атом металла образует связи с несколькими соседними атомами, образуя сеть электронов, называемую «электронным облаком».
Основной механизм металлической связи заключается в обмене электронами между атомами металла. Физическое явление, лежащее в основе этого механизма, называется «деликальзация электронов». В электронном облаке есть свободные электроны, которые могут перемещаться по всей металлической структуре. Это свободное передвижение электронов является причиной, по которой многие металлы обладают высокой электропроводностью и теплопроводностью.
Ненаправленность металлической связи означает, что каждый атом металла равнозначен и может образовывать связи с любыми соседними атомами. Это объясняет, почему металлы обычно имеют кристаллическую структуру и высокую плотность. Каждый атом металла находится в окружении других атомов, образуя регулярную трехмерную решетку.
Ненасыщенность металлической связи означает, что каждый атом металла может участвовать в формировании только определенного числа связей. Это ограничение связано с наличием определенного числа электронов в электронном облаке. Каждый атом металла обычно имеет один или несколько валентных электронов, которые могут образовывать связи с другими атомами.
Определение металлической связи
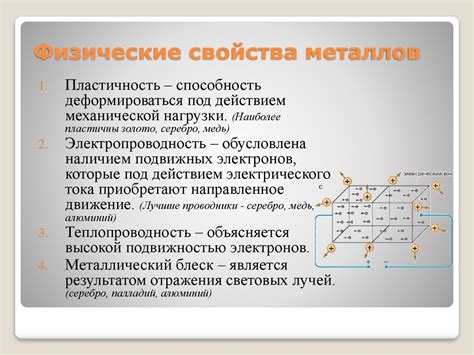
Основной механизм образования металлической связи заключается в обмене электронами между атомами металлов. Электроны в металле находятся в свободном состоянии и могут передвигаться свободно по кристаллической решетке. Причем, в отличие от ковалентных связей, где электроны образуют пары, в металле электроны образуют общую оболочку, называемую "электронным облаком". Таким образом, электроны становятся общедоступными и доступными для других атомов металлов.
Металлическая связь обусловливает такие свойства металлов, как высокая теплопроводность и электропроводность, проводимость металлов в состоянии плавления, а также своеобразную способность металлов образовывать сплавы и способность к деформации без разрушения. Важно отметить, что металлическая связь является более слабой, чем ковалентная связь, поэтому металлы обладают более низкими температурами плавления и кипения по сравнению с веществами с ковалентными или ионными связями.
Структура металлической связи
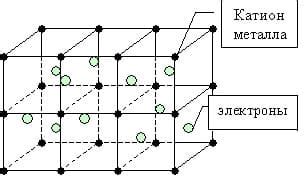
Металлическая связь основана на способности металлов образовывать кристаллическую структуру, которая обеспечивает их высокую проводимость электрического тока и тепла.
В основе структуры металлической связи лежит решетка, состоящая из положительно заряженных ионов металла и свободно движущихся электронов. Ионы металла расположены в решетке в виде кристаллов, где каждый положительно заряженный ион окружен отрицательно заряженными электронами.
Кристаллическая структура металла обеспечивает его механическую прочность, а свободно движущиеся электроны отвечают за проводимость электрического тока. Электроны образуют электронное облако, которое пронизывает всю структуру металла.
Электроны в металле не связаны с конкретными ионами, а постоянно двигаются с высокой скоростью между ними. Это обуславливает ненаправленность и ненасыщенность металлической связи, так как электроны могут двигаться в любом направлении.
Структура металлической связи обладает высокой устойчивостью и позволяет металлам обладать такими характеристиками, как высокая пластичность, теплопроводность, электрическая проводимость. Это делает металлы важными материалами в различных сферах промышленности и техники.
Электронное облако и металлическая связь
В основе металлической связи лежит обмен электронами между атомами металла. В результате этого обмена, электроны становятся общедоступными и могут двигаться по всей металлической структуре. Подобное свойство называется «электронная подвижность».
Электронное облако имеет существенное значение для свойств металлов и их способности проводить ток. Большая плотность электронов в металлической связи обеспечивает высокую электропроводность металлов. Кроме того, электронное облако является причиной блеска и металлического блеска – свойств, которые присущи металлам.
Особенностью металлической связи является тот факт, что электронное облако не связано ни с одним конкретным атомом, а простирается по всей металлической структуре. Это объясняет возможность переноса электрона в любой точке металлической решетки. Благодаря этому, металлы обладают свойством деформации без ломкости – свойством, которое отличает металлическую связь от других типов химических связей.
Таким образом, электронное облако в металле играет важную роль в формировании металлической связи и характеризуется высокой подвижностью электронов, что является основным фактором для объяснения особых свойств металлов.
Внутренняя связь в металлических соединениях
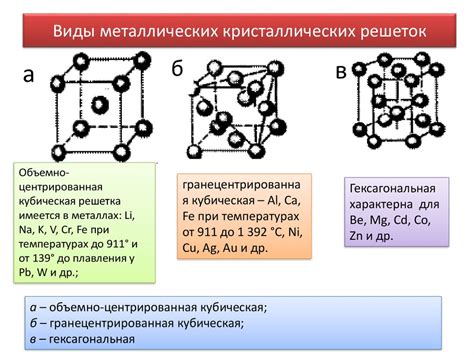
Металлическая связь обусловлена наличием свободных электронов, которые могут двигаться в трехмерной структуре металлической решетки. Это свободное движение электронов придает металлам такие характеристики, как высокая электропроводность и теплопроводность, а также способность к пластичности и деформации.
Причина свободного движения электронов в металлической решетке заключается в ионизации атомов металла. Атомы металла имеют некоторое количество внешних электронов, которые слабо связаны с ядром атома. При образовании металлической решетки эти внешние электроны образуют сферы деформации вокруг каждого атома металла.
В результате перекрывания этих сфер деформации образуется пространство, в котором свободно двигаются электроны. Они образуют так называемую "электронную облако", которое отвечает за связывание атомов и создают электронную структуру металла.
Таким образом, металлическая связь является ненаправленной и ненасыщенной, то есть электроны в металлической решетке не связаны с конкретными атомами, а могут двигаться по всей структуре. Это позволяет металлам обладать такими уникальными свойствами, как высокая пластичность и хорошая проводимость электричества и тепла.
Роль природы и электронной структуры элементов в металлической связи
Связь между атомами в металлической решетке основана на взаимодействии электронного облака с положительно заряженными ионами металла, называемыми ядрами. Отсутствие ограничений на перемещение электронов приводит к низкой плотности электронов в узле решетки, что обуславливает возможность формирования межатомной связи соседних атомов металла.
Электронная структура элементов оказывает существенное влияние на механизм и свойства металлической связи. Связь в металлах может быть осуществлена путем обмена или перекрытия электронных облаков. Различия в энергии уровней электронов и вкладают в электронную структуру элементов могут определять характер металлической связи, его ненаправленность и насыщенность.
Природа элементов также влияет на свойства металлической связи. Например, переходные металлы обладают более сложной электронной структурой, что обуславливает их способность образовывать комплексы и проявлять каталитическую активность. Также, наличие включений других элементов в металл может изменять его электронную структуру и свойства, например, влиять на электропроводность или магнитные свойства металла.
Таким образом, природа и электронная структура элементов играют важную роль в образовании и свойствах металлической связи. Это позволяет объяснить множество особенностей и химических свойств металлов, а также открывает новые возможности для создания и использования материалов с уникальными свойствами.
Ионная связь и металлическая связь

Ионная связь возникает между атомами, в которых есть значительное различие в электроотрицательности. Одни атомы, обладающие меньшей электроотрицательностью, отдают электроны другим атомам, обладающим большей электроотрицательностью. Таким образом, образуются ионы с положительным и отрицательным зарядами, которые притягиваются друг к другу силой электростатического взаимодействия. Это создает устойчивую структуру кристалла или молекулы.
С другой стороны, металлическая связь возникает в металлах, где между атомами образуется «море» свободно движущихся электронов. Эти электроны образуют облако, которое окружает положительные ядра атомов металла. В результате образуется силовое поле, которое удерживает атомы металла вместе в кристаллическую решетку или сеточную структуру.
Важно отметить, что в ионной связи обмен электронами происходит между разными атомами, в то время как в металлической связи электроны перемещаются между соседними атомами металла.
Ионная связь и металлическая связь обладают различными свойствами и играют важную роль в химических реакциях и свойствах соединений. Понимание этих двух типов связей помогает объяснить множество явлений, которые происходят в химии и материаловедении.
</p>
Примеры важных металлических соединений

Металлические соединения играют важную роль в различных областях, таких как промышленность, электроника и катализ. Ниже приведены некоторые примеры важных металлических соединений:
- Железо (Fe) - один из самых распространенных металлов. Используется в производстве стальных конструкций, автомобилей и многих других промышленных отраслях.
- Алюминий (Al) - легкий и прочный металл, широко используемый в авиации, строительстве и упаковочной промышленности.
- Медь (Cu) - отличается высокой электропроводностью и теплопроводностью, применяется в электротехнике, производстве монет и ювелирных изделий.
- Золото (Au) - благодаря своим уникальным свойствам, золото используется в ювелирной промышленности и в производстве электронных устройств.
- Аргентум (Ag) - белое благородное металл, известное как серебро, широко используется в производстве украшений, фотоники и вещественных денег.
Значение металлической связи в промышленности и технологиях

Металлическая связь играет ключевую роль в различных отраслях промышленности и технологии, предоставляя множество преимуществ.
1. Проводимость:
- Металлическая связь обеспечивает хорошую проводимость электричества и тепла, делая металлы и их сплавы идеальными материалами для создания проводов, реле, электродов и других устройств, требующих электрической и тепловой передачи.
- Это позволяет эффективно использовать металлы в электроэнергетике, электронике, авиации и других отраслях промышленности.
2. Прочность и жёсткость:
- Металлическая связь придает материалам прочность и жесткость.
- Металлы и сплавы, связанные металлическими связями, используются для создания конструкций, устойчивых к механическим нагрузкам, таких как мосты, здания, автомобили и многие другие.
3. Формовка:
- Металлическая связь позволяет легко формовать и обрабатывать металлы, что делает их отличными материалами для литья, штамповки, проката и других технологических процессов.
- Это позволяет создавать различные изделия с заданными формами и размерами.
4. Устойчивость к высоким температурам:
- Металлическая связь обеспечивает высокую степень устойчивости металлов к высоким температурам.
- Это позволяет использовать металлы в процессах, связанных с высокими температурами, например, при производстве стали, металлических сплавов и других материалов.
5. Износостойкость:
- Металлическая связь делает материалы более устойчивыми к износу и коррозии.
- Металлы и сплавы, связанные металлическими связями, широко используются в производстве инструментов, машинных деталей, автозапчастей и других изделий, которые должны выдерживать механическое воздействие или взаимодействие с агрессивными средами.
Таким образом, металлическая связь играет важную роль в промышленности и технологиях, обеспечивая проводимость, прочность, формовку, устойчивость к высоким температурам и износостойкость материалов.