Вода – это удивительное вещество, которое имеет способность растворять множество различных веществ. Эта свойство воды является одним из наиболее важных и полезных ее свойств. Но почему вода способна растворять множество веществ, включая соль, сахар, аммиак, кислоты и многое другое? Этому вопросу посвящена данная статья.
Основным фактором, обусловливающим способность воды растворять вещества, является ее поларность. Вода является полярным молекулой, то есть имеет неодинаково распределенные электрические заряды в разных частях молекулы. У воды есть положительно заряженный конец (водородный атом) и отрицательно заряженный конец (кислородный атом). Благодаря такому распределению зарядов, молекулы воды образуют водородные связи с другими молекулами воды и с веществами, что способствует их растворению.
Когда вещество попадает в воду, молекулы воды проникают в межмолекулярное пространство этого вещества и образуют водородные связи с его молекулами. В результате образуется оболочка водных молекул вокруг молекул вещества, что позволяет ему растворяться. Таким образом, растворение вещества в воде происходит благодаря образованию водородных связей между молекулами воды и молекулами вещества.
Кроме того, вода может также взаимодействовать с ионами, образуя растворы солей и кислот. Ионы, составляющие соль или кислоту, реагируют с молекулами воды и образуют гидроксидные или гидроксониевые ионы, которые растворяются в воде. В результате образуется ионная сеть, образованная гидроксидными и гидроксониевыми ионами и молекулами воды, что имеет значительное значение для биохимических процессов, происходящих в организмах.
Растворение веществ в воде: принцип и механизм

Растворение вещества в воде происходит благодаря поларности молекул воды. Вода – полярное вещество, у которого частично заряженные положительные и отрицательные заряды. На положительные заряды влияют отрицательно заряженные частицы, а на отрицательные – положительные частицы. Это взаимодействие между полярными молекулами вызывает образование гидратной оболочки вокруг растворяемого вещества.
Механизм растворения вещества в воде состоит из нескольких стадий. На первой стадии происходит разрушение связей между молекулами растворяемого вещества, образование гидратной оболочки и попадание молекул воды внутрь кристаллической решетки вещества. Затем происходит дальнейшее проникновение молекул воды внутрь решетки и последующее разрушение кристаллической решетки вещества. На последней стадии растворенные молекулы включаются во внутреннюю оболочку и образуют комплексы с растворителем.
| Принципы растворения вещества в воде: |
|---|
| 1. Гидратация – образование гидратной оболочки вокруг растворяемого вещества. |
| 2. Диссоцииация – разрушение связей в кристаллической решетке вещества. |
| 3. Группировка – включение молекул растворенного вещества внутрь водной оболочки. |
| 4. Ассоциация – образование сложных структур внутри растворителя. |
Растворение веществ в воде имеет большое значение в биологии, химии и медицине. Вода обеспечивает необходимую среду для проведения различных химических реакций в организмах, играет роль растворителя в многих лекарственных препаратах и является основой для создания различных растворов и сред.
Физико-химический процесс растворения

Процесс растворения может происходить на уровне молекул или ионов. В случае растворения молекулярных веществ, таких как сахар или спирт, молекулы растворенного вещества разрушаются и окружающие молекулы растворителя образуют вокруг них слои, обеспечивая их равномерное распределение в растворе.
При растворении ионных веществ, таких как соль или кислота, происходит процесс диссоциации: молекулярные соединения распадаются на положительно и отрицательно заряженные ионы. Заряженные ионы окружаются молекулами воды, снижая их межмолекулярные взаимодействия и позволяя взаимодействовать с другими молекулами растворителя.
Вода способна растворять вещества благодаря своей полярности. Молекулы воды состоят из двух атомов водорода и одного атома кислорода, и имеют полярную структуру. Один атом кислорода обладает высокой электроотрицательностью, притягивая электроны к себе сильнее, чем атомы водорода. Это создает разность зарядов и приводит к возникновению положительно и отрицательно заряженных концов молекулы.
Полярность молекул воды позволяет ей вступать во взаимодействие с полярными молекулами растворенных веществ. Положительные концы молекул воды притягивают отрицательно заряженные ионы, а отрицательные концы притягивают положительно заряженные ионы. Это приводит к разрушению взаимодействий между молекулами растворенного вещества и созданию новых взаимодействий с молекулами воды.
В процессе растворения растворенные частицы распределяются равномерно по объему раствора, образуя однородную смесь. Это объясняется возможностью ионов или молекул растворенного вещества свободно перемещаться внутри раствора, под действием теплового движения.
Важно отметить, что растворение водой не является универсальным процессом. Некоторые вещества не растворяются в воде или растворяются в ней очень мало. Это обусловлено различными факторами, такими как концентрация растворенного вещества, температура, давление и химическая структура вещества.
Вода является одной из основных составляющих жизни на Земле и играет важную роль в биологических и химических процессах. Ее способность растворять вещества позволяет различным реакциям и процессам протекать внутри живых организмов и на поверхности планеты. Также она служит основой для многих важных природных и промышленных процессов, включая пищеварение, фотосинтез, гидротермальные и геологические процессы.
Полярность молекул веществ и молекул воды
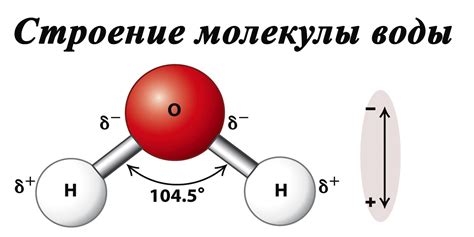
Полярность молекулы воды создает дипольный характер межмолекулярных взаимодействий в жидкости. Вода обладает способностью образовывать водородные связи, которые являются сильными притягивающими силами между молекулами. Вода может вступать в водородные связи с другими водными молекулами и с молекулами других веществ.
Молекулы веществ, которые растворяются в воде, должны быть полярными или иметь полярные группы, чтобы взаимодействовать с полярными молекулами воды. Полярные молекулы при попадании в воду ориентируются таким образом, чтобы их полярные части могли образовать водородные связи с молекулами воды. Это позволяет молекулам вещества растворяться в воде и равномерно распределяться по объему раствора.
Вода также способна растворять несколько веществ, которые не являются полярными, но могут образовывать ионы в растворе. Вода обладает высокой поларизуемостью, что позволяет ей образовывать вокруг молекул вещества гидратные оболочки и удерживать ионы в растворе.
Понятие о водородной связи
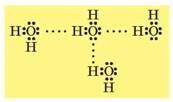
Водородная связь возникает между атомом водорода, присоединенным к электроотрицательному атому, и парой электронов в электронной оболочке другого электроотрицательного атома. Вода, будучи поларным растворителем, обладает высокой электроотрицательностью и способна образовывать водородные связи.
Водородные связи обладают определенными характеристиками, которые влияют на процесс растворения веществ в воде. Прежде всего, водородные связи обеспечивают высокую плотность воды, что позволяет ей быть лучшим растворителем для многих веществ. Кроме того, водородные связи имеют сильное влияние на физические свойства воды, такие как поверхностное натяжение и теплота парообразования.
Водородные связи также способствуют образованию гидратной оболочки вокруг молекул растворенных веществ, что влияет на их химическую реактивность и биологическую активность.
Понимание и изучение водородной связи является важным для понимания многих физических и химических свойств воды и ее способности растворять различные вещества.
Влияние температуры на процесс растворения
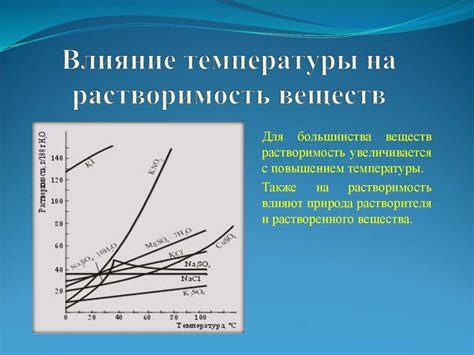
При повышении температуры молекулы воды движутся более интенсивно, что приводит к увеличению энергии и скорости растворения. Более быстрое движение молекул воды проникает в структуру твердого вещества, разрушая связи между его молекулами и позволяя молекулам растворенного вещества вступить во взаимодействие с молекулами воды.
Однако при низких температурах движение молекул замедляется, что может привести к затрудненному растворению некоторых веществ. Это связано с тем, что молекулы воды меньше обсаживают поверхность твердого вещества, и процесс растворения замедляется.
Также влияние температуры на процесс растворения оказывается на растворимость вещества, то есть на количество растворенного вещества, которое может раствориться в определенном количестве воды при данной температуре. Обычно растворимость вещества увеличивается с повышением температуры, так как при более высокой температуре более многочисленные молекулы воды могут вступить во взаимодействие с молекулами растворенного вещества и растворить его. Однако для некоторых веществ растворимость может снижаться с повышением температуры, что связано с изменением их химических свойств или образованием осадков.
В целом, влияние температуры на процесс растворения веществ имеет сложную зависимость, которая может быть объяснена взаимодействием молекул воды и растворенного вещества.
Интермолекулярные силы и растворимость веществ
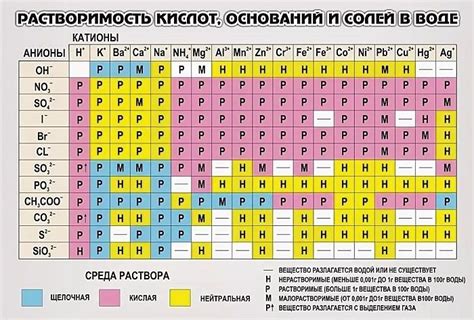
Интермолекулярные силы, такие как водородные связи и диполь-дипольные взаимодействия, играют ключевую роль в растворении веществ в воде. Водородные связи возникают между атомами водорода в одной молекуле и атомами кислорода или азота в другой молекуле. Эти связи являются очень сильными и обуславливают многие свойства воды, включая высокую температуру кипения и плавления.
Диполь-дипольные взаимодействия возникают между полярными молекулами, когда положительный конец одной молекулы притягивается к отрицательному концу другой молекулы. Эти взаимодействия также способствуют растворимости веществ в воде.
Растворимость веществ также зависит от их молекулярной структуры и свойств. Некоторые вещества, такие как поларные молекулы и ионы, легко растворяются в воде, потому что они могут образовывать взаимодействия с водными молекулами. Другие вещества, такие как неполярные молекулы и некоторые ионы, слабо растворяются в воде из-за отсутствия взаимодействий с водными молекулами.
Таким образом, вода растворяет вещества благодаря своей полярности и способности образовывать взаимодействия с молекулами других веществ. Интермолекулярные силы, такие как водородные связи и диполь-дипольные взаимодействия, играют важную роль в этом процессе. Понимание этих сил помогает объяснить механизмы растворения и может быть полезным при изучении физических и химических свойств веществ.



