Аминокислоты – это основные строительные блоки белков, важных компонентов в нашем организме. Каждая из них имеет свою уникальную структуру, но, несмотря на это, они способны взаимодействовать друг с другом.
Взаимодействие аминокислот играет ключевую роль во многих процессах биохимии. Оно может быть как физическим, так и химическим. Физическое взаимодействие – это простое притяжение или отталкивание между аминокислотами, такое как водородные связи или ионные взаимодействия. Химическое взаимодействие, в свою очередь, представляет собой сложную цепочку реакций, в результате которых происходит образование новых соединений или разрушение существующих.
Но почему же аминокислоты взаимодействуют друг с другом? Ответ на этот вопрос связан с их строением и свойствами. Во-первых, аминокислоты могут образовывать связи друг с другом благодаря функциональным группам, таким как аминогруппа и карбоксильная группа. Во-вторых, способность аминокислот образовывать связи позволяет им создавать сложные трехмерные структуры, которые в свою очередь определяют их функции. Кроме того, взаимодействие аминокислот может быть регулировано различными факторами, такими как pH, температура или наличие других молекул.
Взаимодействие аминокислот: основные аспекты

Основными типами взаимодействия между аминокислотами являются силы Ван-дер-Ваальса, водородные связи, ионные связи и гидрофобное взаимодействие.
- Силы Ван-дер-Ваальса: эти слабые притяжения между неполярными атомами или группами атомов играют важную роль в формировании белковой структуры. Они могут быть ответственны за формирование петель и спиралей в пространственной конформации белка.
- Водородные связи: эти связи образуются между положительным водородным атомом и отрицательно заряженным атомом кислорода, азота или фтора. Они играют важную роль в формировании вторичной структуры белка, такой как α-спираль и β-листы.
- Ионные связи: эти связи образуются между заряженными амино- и карбоксильными группами аминокислот. Они могут влиять на электрический заряд и стабильность белковой структуры.
- Гидрофобное взаимодействие: гидрофобные аминокислоты, такие как лейцин или изолейцин, часто предпочитают быть в окружении других гидрофобных остатков, чтобы избегать контакта с водой. Это взаимодействие помогает формированию белковых ядер и стабилизации их структуры.
Взаимодействие аминокислот в белках не только способствует формированию их трехмерной структуры, но и определяет их функциональность. Взаимодействие между различными аминокислотами может способствовать сворачиванию и раскручиванию белковой цепи в определенные конформации, которые являются необходимыми для выполнения различных биологических функций.
Важность аминокислот в организме
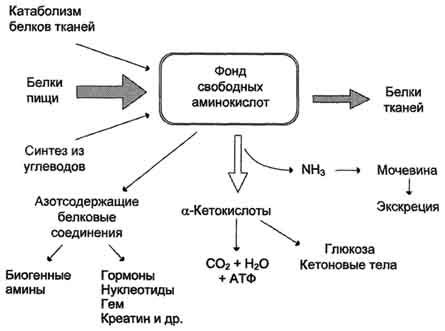
Каждая из 20 аминокислот в организме выполняет свою уникальную функцию, способствуя росту и развитию тканей, восстановлению клеток и поддержанию работы жизненно важных органов. Например, аминокислоты лейцин, изолейцин и валин отвечают за строительство мышц, а аминокислота триптофан является прекурсором серотонина, который участвует в регуляции настроения и сна.
Аминокислоты также взаимодействуют друг с другом, образуя сложные молекулярные структуры. Например, серин и триптофан могут вступать в химические реакции, образуя гликин и серотонин. Такие взаимодействия позволяют организму эффективно использовать аминокислоты и обеспечивать свои потребности в белках.
Недостаток аминокислот в организме может привести к различным заболеваниям и нарушениям функционирования органов. Поэтому важно употреблять пищу, богатую разнообразными и качественными источниками аминокислот, чтобы обеспечить своему организму все необходимые питательные вещества.
Правильное питание с учетом потребностей в аминокислотах является одним из фундаментальных аспектов здорового образа жизни и поддержания оптимального состояния организма.
Формирование связей между аминокислотами
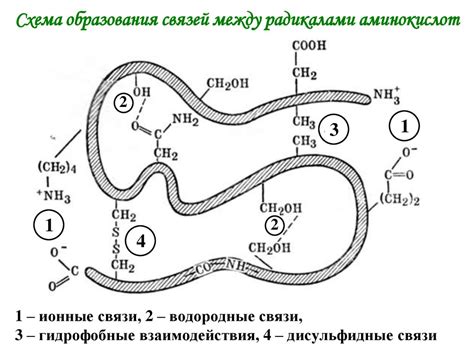
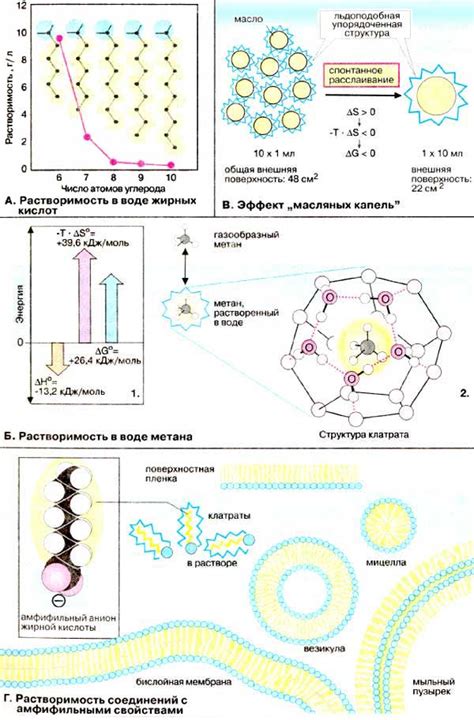
Одним из главных типов связей между аминокислотами является пептидная связь. Она образуется между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты. Пептидная связь образуется путем конденсации, или удаления воды, между этими группами и имеет форму -CO-NH-.
Формирование связей между аминокислотами в пептидной цепи позволяет образовывать различные белковые структуры. Пептидные связи обеспечивают сцепление аминокислот в линейную цепь, которая затем может свернуться в пространственную структуру, образуя вторичную, третичную и кватернарную структуры белка.
Кроме пептидных связей, аминокислоты могут образовывать другие типы связей между собой, такие как гидрофобные взаимодействия, гидрофильные взаимодействия и связи водорода. Гидрофобные взаимодействия возникают между гидрофобными (неполярными) остатками аминокислот и способствуют сворачиванию белка, участвуя в формировании его третичной структуры. Гидрофильные взаимодействия включают силы притяжения между полярными остатками аминокислот и окружающей среды. Связи водорода образуются между атомами водорода и атомами кислорода или азота, создавая дополнительные взаимодействия в белковой структуре.
Формирование связей между аминокислотами осуществляется на уровне молекулы белка и является одним из основных процессов, определяющих его функцию в клетке. Понимание этих связей позволяет понять структуру и функцию белков, а также разрабатывать методы модификации и дизайна новых белковых молекул с определенными свойствами и функциями.
Гидрофобные взаимодействия
Гидрофобные аминокислоты (такие как аланин, валин, лейцин, изолейцин и фенилаланин) имеют неполярные группы, которые не образуют водородные связи с водой. Поэтому они предпочитают остаться внутри белка, в областях, где они могут быть окружены другими гидрофобными аминокислотами. Это приводит к образованию гидрофобных ядер в белковых структурах, где гидрофобные группы аминокислот сосредоточены внутри белка.
Гидрофобные взаимодействия играют важную роль в формировании пространственной структуры белка. Они способствуют созданию стабильных трехмерных конформаций, таких как альфа-спирали и бета-складки. Гидрофобные взаимодействия также могут играть роль в формировании белковых доменов и супрамолекулярных комплексов.
Интересно, что молекулы воды также участвуют в гидрофобных взаимодействиях. Они образуют оболочку вокруг гидрофобных регионов, чтобы минимизировать контакт гидрофобных аминокислот с водой. Это позволяет белкам сохранять свою структуру и функциональность даже в водной среде.
Важно отметить, что гидрофобные взаимодействия не являются привязками или связями между аминокислотами. Вместо этого, они являются слабыми, но важными силами, которые помогают удерживать белковую структуру вместе.
Электростатические взаимодействия

Молекулы аминокислот могут иметь различные заряды, которые зависят от их pH-значения. В нейтральной среде, аминокислоты часто обладают зарядом нуля, но при изменении pH они могут стать заряженными. Положительно заряженные аминокислоты называются аминокислотами с положительным зарядом, а отрицательно заряженные - аминокислотами с отрицательным зарядом.
Аминокислоты со смежными зарядами могут притягиваться друг к другу электростатическими силами. Например, положительно заряженная аминокислота L-лизин может притягивать отрицательно заряженную аминокислоту L-аспартат, образуя электростатическую связь. Это взаимодействие может быть очень сильным и стабильным.
Однако, аминокислоты с одинаковыми зарядами могут отталкиваться друг от друга. Если две положительно заряженные аминокислоты находятся близко друг к другу, они будут отталкиваться электростатическими силами.
Электростатические взаимодействия между аминокислотами играют важную роль в стабилизации белковой структуры и взаимодействии функциональных групп с другими молекулами. Изучение электростатического взаимодействия между аминокислотами позволяет лучше понять механизмы биологических процессов и разработать новые лекарственные препараты.
Изомеры аминокислот и их роль во взаимодействии
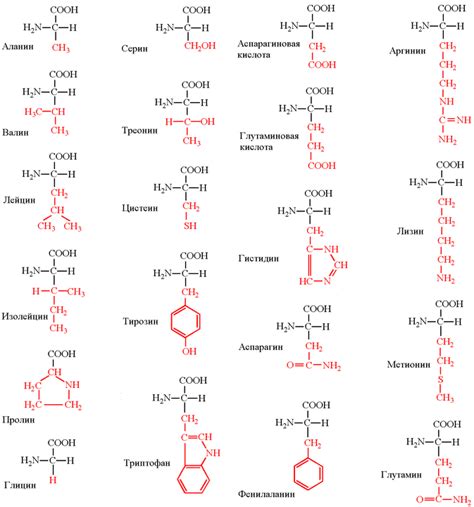
Аминокислоты, основные строительные блоки белков, могут существовать в форме изомеров, то есть молекул с одинаковым химическим составом, но различной структурой. Изомеры аминокислот играют важную роль во взаимодействии этих молекул друг с другом.
Одним из наиболее распространенных изомеров аминокислот являются D-изомеры, которые отличаются от L-изомеров зеркальным отражением своей структуры. В природе встречаются преимущественно L-изомеры, которые входят в состав белков и участвуют в биохимических процессах организма.
Взаимодействие аминокислот происходит за счет различных химических групп, присутствующих в их структуре. Одна из таких групп - карбоксильная группа (-COOH), которая может образовывать водородные связи с аминогруппой (-NH2) другой аминокислоты. Это позволяет образовывать цепочки аминокислот, связанные между собой внутримолекулярными или межмолекулярными водородными связями.
| Аминокислота | Структура | Роль во взаимодействии |
|---|---|---|
| Glycine |  | Глицин, самая простая аминокислота, участвует в образовании водородных связей и обеспечивает гибкость белковой структуры. |
| Lysine |  | Лизин, имеющий аминогруппу (-NH2) на боковой цепи, может образовывать ионные связи с другими аминокислотами, что способствует стабилизации белков. |
| Cysteine |  | Цистеин, в участвующий в формировании дисульфидных мостиков между различными цепями аминокислот, что увеличивает степень устойчивости белковой структуры. |
Изомеры аминокислот обладают разными физико-химическими свойствами и способностью взаимодействовать с другими молекулами. Это позволяет им выполнять различные функции в организме, от участия в синтезе белков до регуляции биохимических процессов.
Гидрофильные взаимодействия
Гидрофильность - это способность молекулы притягивать к себе молекулы воды. Аминокислоты содержат положительные и отрицательные функциональные группы. Положительные группы - аминогруппы и группы имидазола висят у эфирных аминокислот, притягивают молекулы воды с отрицательным зарядом, такие как окись серы, полусумма положительного заряда этих групп и отрицательного заряда атома окиси серы. В результате образуются водородные связи между этими группами и молекулами воды.
Такие гидрофильные взаимодействия не только способствуют солюбилизации аминокислот в воде, но и могут играть важную роль в структуре белка. Например, водородные связи между гидрофильными аминокислотами могут стабилизировать протяженные цепочки белка и формировать вторичную структуру, такую как альфа-спираль или бета-складка.
Валентные связи между аминокислотами
Валентные связи между аминокислотами играют важную роль в структуре белков и их функциональность. Они образуются при обмене электронами между атомами аминокислот и приводят к образованию полимерной цепи белка.
Связи между аминокислотами могут быть различной природы. В одном случае они могут быть ковалентными, то есть образовываться при совместном электронном обмене. В другом случае связи между аминокислотами могут быть не координационными, но все равно достаточно сильными для того, чтобы поддерживать структуру белка.
Особенно важны валентные связи между аминокислотами при формировании третичной и кватернической структуры белка. Внутри белковой молекулы различные аминокислоты могут образовывать сильные связи, такие как дисульфидные мосты, ионные связи и водородные связи.
Дисульфидные мосты - это связи, образующиеся между атомами серы в боковых цепях некоторых аминокислот. Они играют важную роль в структуре белка, обеспечивая его стабильность и прочность.
Ионные связи возникают между атомами с различной электроотрицательностью. Например, положительный аминогруппа может образовывать ионные связи с отрицательными карбоксильными группами или другими отрицательными атомами. Эти связи также способствуют стабильности и прочности белковой структуры.
Водородные связи - это взаимодействие между положительным атомом водорода и электроотрицательным атомом кислорода, азота или фтора. Они слабее, чем ковалентные связи, но все равно очень важны для структуры белка.
Валентные связи между аминокислотами играют ключевую роль в формировании и функционировании белковых молекул. Они обеспечивают стабильность, гибкость и специфичность белковой структуры, позволяя им выполнять различные функции в организме.
Биологическая значимость взаимодействия аминокислот
Одной из ключевых функций аминокислот является их участие в синтезе белков. В процессе трансляции генетической информации, аминокислоты соединяются в определенной последовательности при помощи пептидных связей, образуя полипептидные цепи. Эти цепи последующими взаимодействиями превращаются в функциональные белки, выполняющие разнообразные задачи, такие как катализ химических реакций, перенос молекул и информации в клетках.
Кроме того, аминокислоты способны образовывать различные химические связи между собой. Одна из таких связей - дисульфидные мостики, которые образуются при взаимодействии серных атомов в цистеиновых остатках. Эти связи обеспечивают стабильность и прочность пространственной структуры белков, что крайне важно для их функционирования.
Взаимодействие аминокислот также позволяет образовывать различные функциональные участки внутри белков. Некоторые аминокислоты способны образовывать водородные связи или электростатические взаимодействия с другими аминокислотами, что позволяет создавать активные центры или связывающие области белков.
Наконец, взаимодействие аминокислот имеет важное значение для обеспечения структурной и функциональной разнообразности белков. Различные комбинации и последовательности аминокислотных остатков позволяют создавать разнообразные пространственные структуры и специфичность связывания, что определяет специализацию и разнообразие белков в организмах.
Таким образом, взаимодействие аминокислот является необходимым условием для правильного функционирования белков и жизнедеятельности клеток и организмов в целом.



