Молекулярная сила притяжения – это remarkable natural phenomenon, providing the basis for numerous everyday experiences. We are all familiar with situations when objects seemingly stick together, like a pen cap sticking to the pen, or two glass plates becoming attached. Эти привычные явления можно объяснить через молекулярные силы притяжения, которые действуют между молекулами твердого вещества, создавая наблюдаемые эффекты притяжения.
Молекулы – это маленькие частицы, из которых состоят все вещества. Когда два объекта находятся на достаточно близком расстоянии, их молекулы начинают взаимодействовать. И есть три типа молекулярных сил: дисперсионные силы, силы ковалентных связей и силы водородных связей. Дисперсионные силы, также известные как силы Лондоновского дисперсионного типа, являются наиболее слабыми, но они действуют между всеми молекулами и могут быть ответственными за прилипание двух поверхностей.
Так почему половинки ручки прилипают друг к другу? Когда мы насаждаем крышку на ручку, молекулы на поверхности ручки и крышки вступают во взаимодействие между собой. Дисперсионные силы создают молекулярные привязки, которые удерживают ручку и крышку вместе, образуя непрочные связи. Когда мы отделяем крышку от ручки, эти связи больше не действуют, и мы можем легко разъединить эти две части.
Что такое молекулярные силы притяжения?

Молекулярные силы притяжения возникают в результате взаимодействия между электронами во внешней оболочке атомов разных молекул. Они могут быть двух типов: дисперсионные (Лондоновские) силы и полярные силы. Дисперсионные силы являются самыми слабыми и возникают из-за временного изменения распределения электронов в молекуле. Полярные силы возникают между молекулами, в которых электроотрицательность атомов неравна и создают электрический диполь.
Молекулярные силы притяжения важны, так как они определяют фазовые переходы вещества, его плотность, температуру кипения и многое другое. Например, когда мы прижимаем две половинки ручки, молекулярные силы притяжения между ними начинают действовать, и они прилипают друг к другу. Это объясняется тем, что на поверхности молекул воздуха действуют слабые лондоновские силы, которые обусловлены временными изменениями распределения электронных облаков. В результате, небольшие молекулы воздуха прилипают к поверхности ручки, образуя невидимый слой адгезионного вещества.
Основные принципы молекулярных сил притяжения
Молекулярные силы притяжения играют важную роль во многих явлениях природы, включая физическую и химическую реакции, биологические процессы и поведение вещества в различных состояниях. Эти силы возникают между молекулами и определяют их взаимодействие и структуру.
Одним из основных принципов молекулярных сил притяжения является принцип электростатического взаимодействия. Положительные и отрицательные электрические заряды молекул притягиваются друг к другу и создают силы притяжения. Это объясняет, почему половинки ручки прилипают друг к другу - заряженные частицы в молекулах создают силы, притягивающие их друг к другу.
Другим важным принципом является принцип дисперсионных сил. Молекулы имеют временные изменения электронной структуры, которые могут создавать временные диполи. Эти временные диполи взаимодействуют с соседними молекулами и создают силы притяжения. Этот принцип также объясняет, почему половинки ручки прилипают друг к другу - временные диполи в молекулах создают временные силы притяжения.
Ещё одним важным принципом является принцип водородной связи. Водородная связь возникает между атомами водорода и электронными парами, находящимися на атомах кислорода, азота или фтора. Водородная связь является очень сильной и может создавать мощные силы притяжения между молекулами. Водородная связь также объясняет, почему половинки ручки прилипают друг к другу - между молекулами вещества создаются водородные связи.
Все эти принципы молекулярных сил притяжения объясняют сложные взаимодействия между молекулами, которые происходят в природе и в повседневной жизни. Они помогают понять, почему некоторые вещества прилипают друг к другу, а другие нет, и являются основой многих физических и химических процессов.
Как работают адгезивные силы
Адгезивные силы возникают благодаря взаимодействию между молекулами на поверхности разных материалов. Когда две поверхности соприкасаются, молекулы одной поверхности притягиваются к молекулам другой поверхности. Это притяжение происходит благодаря электростатическим и ван-дер-Ваальсовым силам.
Электростатические силы возникают из-за разности зарядов на поверхностях молекул. В некоторых случаях, одна поверхность может иметь положительный заряд, а другая – отрицательный. Это приводит к электростатическим притяжению между молекулами, что делает материалы прилипающими.
Ван-дер-Ваальсовы силы возникают благодаря временным изменениям электронной оболочки молекул. Эти маленькие изменения создают мгновенные диполи, которые могут притягиваться друг к другу. И хотя эти силы слабее, чем электростатические, в совокупности они могут оказывать существенное влияние.
Адгезивные силы, также, зависят от свойств поверхностей материалов. Грубая и неровная поверхность может создавать больше точек контакта, что повышает силу адгезии. Кроме того, химические свойства материалов также играют роль. Например, если поверхности материалов хорошо совместимы, то адгезивные силы будут сильнее.
Изучение адгезивных сил имеет большое значение для разработки новых материалов и технологий. Понимание принципов работы адгезии позволяет создавать более прочные, эффективные и долговечные соединения.
Роль водородных связей в притяжении
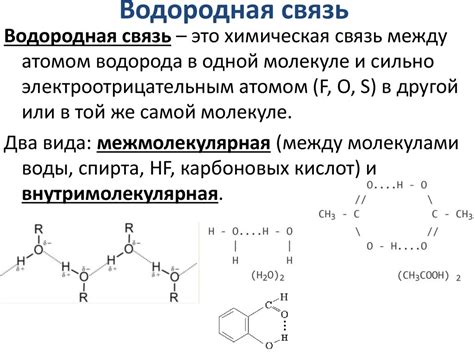
Особенность водородной связи заключается в том, что она обладает направленным характером, то есть электроотрицательный атом притягивает электронную плотность водорода и создает слабый электростатический диполь. В результате возникает сильное притяжение между молекулами, которое может превышать межмолекулярные взаимодействия в других типах веществ.
Водородные связи играют важную роль во многих биологических и химических процессах. Они обеспечивают стабильность иммунных комплексов, строение белков и ДНК, а также определяют свойства многих веществ, таких как вода и алкоголи. Также водородные связи отвечают за различные физические явления, такие как поверхностное натяжение и способность воды к поглощению тепла.
Важно отметить, что водородные связи являются не только причиной притяжения между молекулами, но и определяют основную структуру многих веществ. Например, вода образует тетраэдрическую структуру благодаря водородным связям между соседними молекулами, что придает ей уникальные свойства и позволяет существование жизни на Земле.
Таким образом, водородные связи играют важную роль в притяжении между молекулами и определяют свойства многих веществ. Изучение этого типа молекулярных сил притяжения является не только важной темой в химии, но и позволяет более глубоко понять различные физические и биологические процессы.
Молекулярные силы и притяжение речных песчинок

Молекулярными силами притяжения занимается отдельная область науки, известная как молекулярная физика. Эти силы играют важную роль в объяснении различных физических явлений, таких как сцепление материалов и молекул, образование пленок и т. д. Как правило, молекулярные силы притяжения между молекулами возникают в результате диполь-дипольного взаимодействия, ковалентной связи или водородной связи.
Одним из интересных примеров молекулярных сил и притяжения является поведение речных песчинок. Когда две песчинки оказываются рядом, между ними возникает притяжение, вызванное молекулярными силами притяжения. Это притяжение связано с тем, что молекулы песчинок обладают положительными и отрицательными зарядами.
Для дальнейшего объяснения этого явления полезно рассмотреть модель диполя. Диполь – это система из двух одинаковых, но противоположно заряженных частей, разделенных небольшим расстоянием. В случае с речными песчинками, молекулы на их поверхности могут быть рассмотрены как диполи, с положительно заряженными частями (ядрами) и отрицательно заряженными частями (электронами).
Когда две песчинки приближаются друг к другу, положительно заряженные и отрицательно заряженные части молекул вступают во взаимодействие. Таким образом, возникает притяжение, которое приводит к сцеплению песчинок. Чем больше молекул, участвующих в этом взаимодействии, тем сильнее притяжение между песчинками.
Интересно отметить, что молекулярные силы притяжения также играют важную роль при формировании пузырьков на поверхности воды или между двумя жидкостями. Это объясняет, почему пузырьки склеиваются, а не разбиваются при соприкосновении.
Таким образом, молекулярные силы притяжения имеют большое значение не только в макроскопических объектах, таких как речные песчинки, но и в микромире, в бесконечно малых частицах. Их понимание помогает объяснить ряд интересных физических явлений, которые мы часто наблюдаем в повседневной жизни.
Молекулярные силы и притяжение жидкости в стакане

Молекулярные силы притяжения играют важную роль в объяснении многих физических явлений, включая причину, почему жидкость остается в стакане, не выплескиваясь. Эти силы возникают между молекулами вещества и обусловлены электростатическими взаимодействиями и силами Ван-дер-Ваальса.
В результате молекулярных сил притяжения, жидкость образует поверхностное натяжение, которое позволяет ей формировать выпуклую поверхность и не выплескиваться из стакана. Когда стакан с жидкостью находится на горизонтальной поверхности, силы притяжения между молекулами жидкости и поверхности стола уравновешиваются, и жидкость остается в стакане.
Внутри стакана жидкость прилипает к стенкам стакана, так как молекулы жидкости притягиваются друг к другу силами Ван-дер-Ваальса. Эти силы взаимодействия молекул создают своего рода притяжение, которое придает жидкости свойства капиллярного эффекта. Капиллярное давление внутри узкого стакана позволяет жидкости подниматься выше уровня свободной жидкости в широком стакане.
Таким образом, равновесие сил притяжения внутри стакана позволяет жидкости оставаться в нем и сохранять свою форму. Молекулярные силы притяжения важны не только для понимания причины, почему половинки ручки прилипают друг к другу, но и для объяснения многих других физических явлений в природе.
Молекулярные силы и прилипание половинок ручки

При использовании ручки мы иногда замечаем, что половинки ручки прилипают друг к другу. Это явление вызвано молекулярными силами притяжения.
Молекулярные силы притяжения – это силы, действующие между молекулами и приводящие к их взаимодействию. Силы притяжения между молекулами обусловлены взаимодействием электронов и атомных ядер молекул.
В случае с половинками ручки, это взаимодействие происходит на поверхности молекул. За счет молекулярных сил притяжения, половинки ручки начинают взаимодействовать и прилипают друг к другу.
Силы притяжения, действующие между молекулами, могут быть ван-дер-ваальсовыми силами или другими типами сил. В случае с половинками ручки, наиболее вероятно, что это ван-дер-ваальсовы силы. Ван-дер-ваальсовы силы – это слабые силы притяжения, действующие между атомами и молекулами.
Они возникают из-за временных несоответствий в расположении электронов внутри атомов или молекул. Эти временные несоответствия создают моментарные диполи, которые притягивают другие молекулы к себе.
Именно ван-дер-ваальсовы силы притяжения вызывают прилипание половинок ручки. При соприкосновении поверхностей половинок ручки, молекулы начинают взаимодействовать через ван-дер-ваальсовы силы и притягивают друг друга. Эти силы достаточно слабые, поэтому половинки ручки легко отделяются друг от друга при небольшом приложении силы.
Таким образом, прилипание половинок ручки – это результат взаимодействия молекул через молекулярные силы притяжения, в частности ван-дер-ваальсовы силы.
Примеры молекулярных сил притяжения в повседневной жизни
Молекулярные силы притяжения играют важную роль в нашей повседневной жизни. Вот несколько примеров, которые мы можем встретить каждый день:
1. Пристегивание ремней безопасности
Когда мы пристегиваем ремни безопасности в автомобиле, молекулярные силы притяжения играют ключевую роль в том, чтобы удержать нас на месте при возможном столкновении. Силы притяжения между молекулами ремня и молекулами одежды или кожи создают сопротивление и помогают предотвратить движение тела в случае аварии.
2. Сцепление волос
Когда наши волосы сцепляются друг с другом, это обусловлено молекулярными силами притяжения. Молекулы волос взаимодействуют друг с другом, создавая прочное сцепление и способствуя образованию узлов и завитков.
3. Прилипание листов бумаги
Когда два листа бумаги прилипают друг к другу, за это отвечают молекулярные силы притяжения. Молекулы поверхности бумаги взаимодействуют друг с другом и создают сцепление, которое делает слои бумаги трудными для разделения.
4. Прилипание молекул воды к поверхности стекла
На поверхности стекла молекулы воды могут прилипать благодаря молекулярным силам притяжения. Это объясняет явление поверхностного натяжения и позволяет, например, наливать воду в стакан до самого края без ее пролива.
5. Сцепление пластмассовых предметов
Молекулярные силы притяжения также могут быть ответственными за сцепление пластмассовых предметов. Молекулы пластмассы могут взаимодействовать с другими поверхностями и создавать прочное сцепление, например, при использовании пластиковых закрыток на бутылках.
Все эти примеры демонстрируют важность молекулярных сил притяжения в нашей повседневной жизни и показывают, как они влияют на различные аспекты нашего окружения и использования предметов.



