Атом – это базовая единица материи, состоящая из ядра и электронной оболочки. Исторически сложилось, что ядро атома отвечает за его массу и содержит большую часть его массы. Именно поэтому его иногда называют "нуклеарным" (от латинского слова "nucleus"), чтобы подчеркнуть его центральное положение в атоме.
Модель атома – это концепция, объясняющая строение и поведение атома. Одной из первых моделей атома была планетарная модель, предложенная Эрнестом Резерфордом в начале XX века. Она предполагала, что электроны вращаются вокруг положительно заряженного ядра атома, подобно планетам вокруг Солнца.
Однако, планетарная модель не объясняла некоторые явления, такие как устойчивость атомов и спектральные линии, наблюдаемые в спектрах элементов. Это привело к разработке квантовой механической модели атома, которая была предложена Нильсом Бором. Согласно этой модели, электроны находятся в дискретных энергетических уровнях вокруг ядра. Распределение электронов по уровням описывается квантово-механическими правилами.
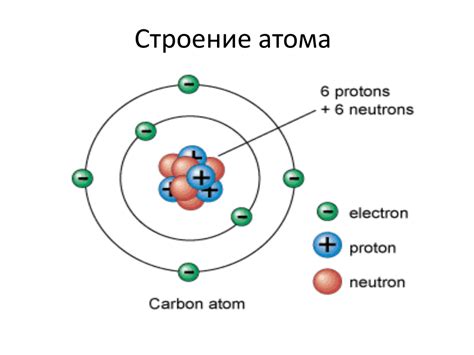
Термин "нуклеарная" также отражает то, что ядро атома содержит протоны и нейтроны, два классических подвида нуклонов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Вместе они образуют ядро атома, определяющее его массу. Электроны, в свою очередь, имеют отрицательный заряд и находятся на энергетических уровнях вокруг ядра. Такое строение атома обуславливает его свойства и взаимодействия с другими атомами.
Модель строения атома: ее основные концепции
Нуклеус, или ядро атома, является его центральным компонентом. В нуклеусе содержатся два типа частиц: протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда вообще.
Протоны и нейтроны обладают массой, которая является основной составляющей массы атома. Они называются нуклонами. Масса нуклонов измеряется в единицах, называемых атомными массовыми единицами (а. е. м.).
Электроны представляют собой легкие частицы с отрицательным зарядом, которые обращаются вокруг ядра на определенных энергетических уровнях или орбитах. Количество электронов в атоме обычно равно количеству протонов, что позволяет атому быть нейтральным.
Основные концепции модели строения атома, включая наличие нейтронов и электронных орбит, были разработаны в начале XX века и с тех пор были подтверждены множеством экспериментов.
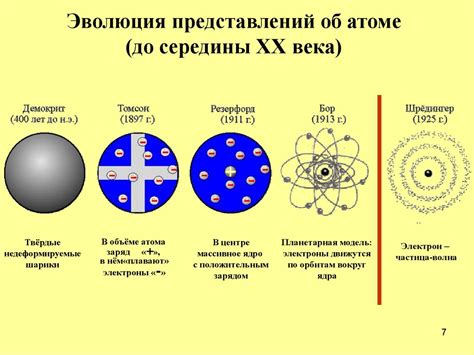
Развитие представления о строении атома

В 1803 году английский ученый Джон Долтон предложил первую научную модель строения атома, называемую «твердая сфера». По его предположениям, атом состоит из неделимых и непроницаемых частиц, которые он назвал атомами. Эта модель считала атомы неделимыми и непроницаемыми, и считалось, что они не могут разрушаться или создаваться.
Следующим значительным прорывом в представлении о строении атома стала модель, предложенная Джозефом Джоном Томпсоном в 1897 году. Он предложил модель «пудинга с изюмом», в которой атом представлялся в виде позитивно заряженной массы с электронами, расположенными внутри него. Эта модель стала первым шагом к пониманию, что атом состоит из различных частиц с разными зарядами.
В 1911 году нью-зеландский физик Эрнест Резерфорд провел серию экспериментов, известных как эксперименты по рассеянию альфа-частиц. Он предложил модель, в которой атом представлен в виде большого и пустого пространства, вокруг которого вращаются электроны. Он также установил присутствие частиц с положительным зарядом, которые он назвал ядром атома. Модель Резерфорда была первой моделью, которая учитывала наличие ядра внутри атома.
В 1913 году датский физик Нильс Бор развил модель Резерфорда, введя понятие энергетических уровней электронов вокруг ядра. Эта модель объясняла спектральные линии атомов и устанавлила понятие квантовой механики в атомной физике.
В последующие годы и десятилетия ученые разработали различные модели строения атома, которые учитывают такие факторы, как движение электронов, их орбитальный момент, а также взаимодействие с другими атомами. Современные модели строения атома, такие как модель волновой функции, являются результатом сложных теоретических исследований и экспериментов.
Открытие ядра атома: ключевой этап в развитии модели
В истории нашего понимания строения атома одним из ключевых моментов стало открытие ядра. Этот важный этап в развитии модели атома помог уточнить представление о его структуре и свойствах.
Работа по исследованию атома началась задолго до открытия ядра. Ученые проводили эксперименты, изучали свойства различных элементов и их соединений. Однако, несмотря на значительные достижения, они всё же не имели полного представления о внутреннем устройстве атома.
Всё изменилось в 1911 году, когда Эрнест Резерфорд провел известный эксперимент с рассеянием альфа-частиц на тонкой фольге. В результате эксперимента Резерфорд пришел к существенным открытиям, которые потрясли научное сообщество.
Оказалось, что большая часть альфа-частиц проходит через фольгу практически без отклонений. Однако, некоторые из них отклонялись под острыми углами или даже возвращались назад. Это противоречило существовавшей модели атома, предполагавшей, что положительный заряд в атоме равномерно распределен.
Резерфорд смог объяснить эти отклонения, предположив, что во внутренней части атома находится небольшое, но очень плотное и заряженное ядро. Именно это ядро притягивает альфа-частицы и отклоняет их от своей траектории.
Постепенно модель атома стала дополняться и развиваться, ученые делали новые открытия и эксперименты. Однако, открытие ядра атома было важным шагом, который позволил ученым двигаться вперед и расширять свои знания.
Ядро атома: состав и структура
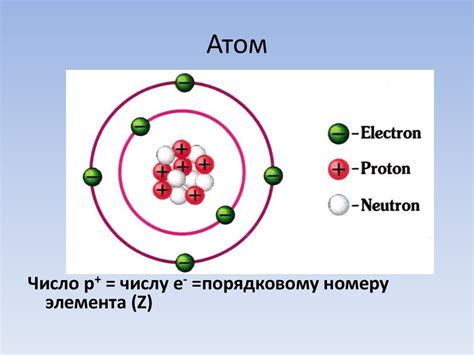
Ядро атома представляет собой одну из основных частей атома, отвечающую за его массу и являющуюся источником его стабильности.
Основные составляющие ядра атома - это протоны и нейтроны. Протоны являются положительно заряженными частицами, а нейтроны не имеют электрического заряда и являются нейтральными.
Структура ядра атома представляет собой аккуратно упакованный набор протонов и нейтронов. Протоны и нейтроны находятся очень близко друг к другу, что обеспечивает их стабильность. Если бы один из этих стабильных элементов отделился от ядра, атом потерял бы свою структуру и превратился в другой элемент.
| Составляющие | Протоны | Нейтроны |
|---|---|---|
| Заряд | Положительный (+) | Нейтральный |
| Масса | Относительная масса 1,007276 | Относительная масса 1,008665 |
| Расположение | Внутри ядра атома | Внутри ядра атома |
Именно ядро атома определяет его химические свойства и массовое число. Массовое число атома равно сумме протонов и нейтронов в ядре.
Расширенное понимание структуры и состава ядра атома позволило человечеству создавать и использовать ядерные реакции, которые нашли свое применение в различных областях, включая энергетику и медицину.
Электронная оболочка: основные компоненты
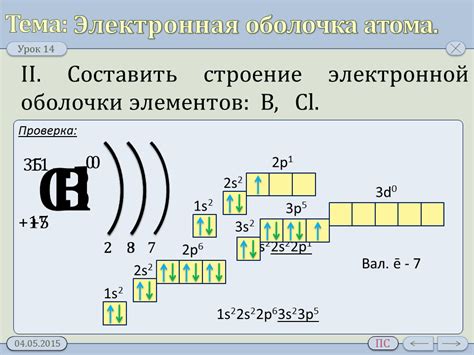
Нуклеарная модель атома предполагает, что вокруг центрального ядра, состоящего из протонов и нейтронов, находится электронная оболочка. Электронная оболочка состоит из электронов, которые обращаются по определенным орбитам вокруг ядра.
Основными компонентами электронной оболочки являются:
| Компонент | Обозначение | Описание |
|---|---|---|
| Энергетический уровень | n | Обозначает расстояние от ядра, на котором находится орбита (энергетический уровень) электрона. Чем ближе энергетический уровень к ядру, тем ниже его энергия. |
| Орбиталь | l | Орбиталь определяет форму электронной орбиты. Уровень энергии электрона зависит от его орбитали. |
| Магнитное квантовое число | m | Магнитное квантовое число определяет ориентацию орбитали в пространстве относительно магнитного поля. |
| Спин | s | Спин определяет свойство электрона, связанное с его вращением вокруг своей оси. Спин может быть направлен вверх или вниз (выражается значением +1/2 или -1/2). |
Электронная оболочка атома определяет его химические свойства и взаимодействие с другими атомами. Понимание структуры и компонентов электронной оболочки является важным для объяснения различных явлений и свойств в области атомной физики и химии.
Сферы движения электронов: квантовая теория

Согласно квантовой теории, сферы движения электрона представляют собой облака вероятности, называемые орбиталями. Они описывают вероятность нахождения электрона в определенной области пространства. Орбитали имеют свою форму, которая определяется энергией электрона.
В простейшем случае, сферы движения электрона могут быть представлены сферическими орбиталями s-типа, имеющими форму шара вокруг ядра атома. Они проникают внутрь ядра и простираются в окружающее пространство. Также существуют p-тип орбиталей, которые имеют форму двуполюсных фигур и простираются вдоль осей координат.
Сферы движения электронов могут быть описаны квантовыми числами, такими как главное, орбитальное и магнитное квантовые числа. Они определяют энергетический уровень электрона, форму орбитали и его магнитное поведение в магнитном поле.
Квантовая теория помогает объяснить структуру и свойства атома, включая спектры испускания и поглощения энергии. Она позволяет предсказывать расположение электронов в атоме и понять, почему атомы соединяются, образуя молекулы. Эта теория является основой современной химии и физики атома.
Модель "нуклеарная": обоснование термина

В модели "нуклеарной" атома предполагается, что большая часть массы атома сосредоточена в его ядре, внутри которого находятся положительно заряженные протоны и нейтроны – нейтральные по заряду частицы. Электроны, имеющие отрицательный заряд, окружают ядро и находятся на определенных энергетических уровнях, образуя так называемую "область электронной оболочки".
Термин "нуклеарная" происходит от латинского слова "nucleus", что означает "ядро". Он используется для подчеркивания роли и значения ядра в строении атома. Ядро атома содержит почти всю его массу, и оно является центральной и наиболее существенной частью атома. Именно ядро определяет химические свойства элемента и его массовое число.
Модель "нуклеарная" атома была разработана в начале XX века и стала одной из первых попыток объяснить строение атома на основе экспериментальных данных. Она позволила установить, что атом состоит из трех основных частиц: электронов, протонов и нейтронов. Эта модель с успехом использовалась для объяснения множества физических и химических явлений и стала основой для дальнейших исследований и разработок в области атомной физики и химии.
Термин "нуклеарная" в модели строения атома подчеркивает значимость ядра и его влияние на свойства и поведение атома. На протяжении многих десятилетий модель "нуклеарная" оставалась одной из основных и наиболее принятых моделей строения атома, пока не была развита квантовая механика, которая полностью описывает поведение электронов в атоме.
Сравнение моделей строения атома
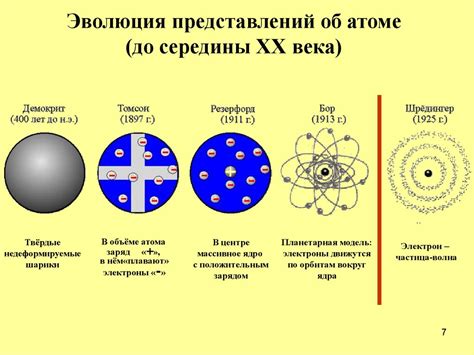
В истории развития научных представлений о строении атома существовало несколько моделей. Каждая из них вносила свой вклад в понимание нуклеарной структуры атома и решение различных физических задач.
Одной из первых моделей была модель "пудинга с изюмом", предложенная Джозефом Джоном Томпсоном в 1897 году. Эта модель представляла атом как сферический положительно заряженный "пудинг", в котором были встроены негативно заряженные "изюминки" - электроны. Эта модель позволяла объяснить некоторые экспериментальные результаты, но не смогла справиться с некоторыми наблюдаемыми эффектами, такими как радиоактивность.
В 1911 году Эрнест Резерфорд предложил модель, которая описывала строение атома, называемую нуклеарной моделью. Согласно этой модели, атом представлял собой миниатюрную солнечную систему, где положительно заряженное ядро, содержащее практически всю массу атома и почти все положительное зарядное число, находилось в центре, а электроны вращались вокруг него по определенным орбитам. Эта модель позволяла объяснить феномен рассеяния альфа-частиц и определить радиус атома.
Однако нуклеарная модель не могла объяснить стабильность атома и его способность неизменно сохранять свои качества. В 1913 году Нильс Бор предложил свою модель, известную как модель Бора. Согласно этой модели, электроны не двигались по орбитам случайно, а занимали определенные энергетические уровни, на которых они могли находиться. Переходы электронов между уровнями вызывали испускание или поглощение энергии в виде квантов. Модель Бора позволила объяснить линейчатый спектр водорода и стабильность атома в целом.
| Модель | Автор | Основные характеристики |
|---|---|---|
| Модель "пудинга с изюмом" | Джозеф Джон Томпсон | Сферический положительно заряженный "пудинг" с встроенными электронами |
| Нуклеарная модель | Эрнест Резерфорд | Ядро в центре и электроны, вращающиеся по орбитам |
| Модель Бора | Нильс Бор | Электроны на энергетических уровнях, переходы с испусканием или поглощением энергии |
Каждая из этих моделей вносила свой вклад в развитие понимания строения атома и объяснение его основных свойств. Сегодня мы знаем, что модель Бора оказалась ближе к истине, но все эти модели играли важную роль в научных исследованиях и являются важными этапами в развитии атомной физики.